[이데일리 박태진 기자] 이번 주말에는
메드팩토(235980)에 대해 알아보겠습니다.
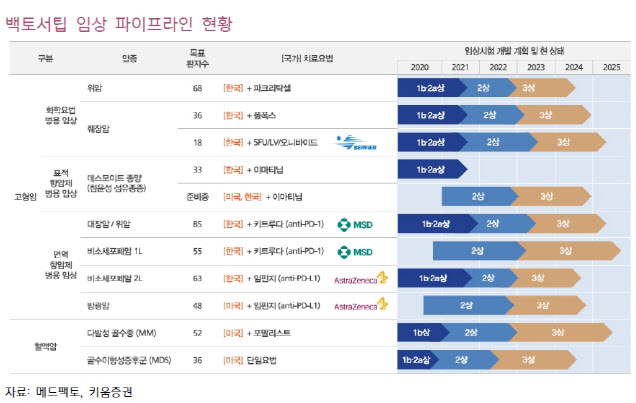
2013년에 설립된 메드팩토는 신약 연구 및 개발 회사입니다. 지난해 12월 코스닥시장에 상장했죠. 이 회사는 현재 신약으로 개발 중인 ‘백토서팁’을 통해 비소세포폐암 1차 치료제 시장에 도전하고 있습니다. 이 부분이 회사의 앞으로 체크 포인트입니다. 특히 병용임상 시험을 통해 모든 암종으로의 적응증 확대 가능성이 입증됐다는 분석도 나오고 있습니다.
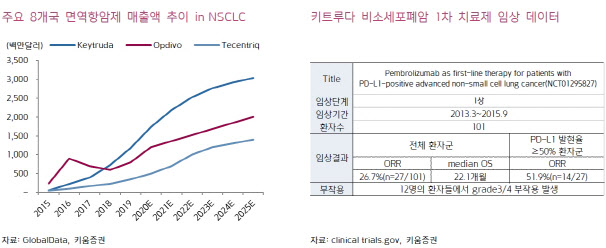
메드팩토는 지난 4일 비소세포폐암 1차 치료제로 백토서팁과 글로벌 제약사 머크(MSD)가 개발한 면역항암제 ‘키트루다’와 국내 임상 2상을 신청했죠. 이번 임상 역시 기존의 면역항암제 병용임상과 마찬가지로 머크에서 키트루다 약물 비용을 지원합니다. 총 55명의 환자를 대상으로 하며 올해 하반기 환자 모집을 완료할 것으로 예상합니다.
2·3차 치료제 임상은 환자군이 적고 중증 환자 대상이기 때문에 약물 부작용 및 임상 중단율이 높지만, 이번에 새롭게 진입한 시소세포폐암 1차 치료제 임상의 경우 높은 객관적 반응률(ORR), 낮은 부작용 등 안정적인 데이터 도출이 기대됩니다.
김상표 키움증권 연구원은 “현재까지는 키트루다가 비소세포폐암 시장 내에서 선도를 유지하고 있지만 경쟁사 제품인 옵디보, 티센트릭 등 매출 성장세에 밀려 올해를 기점으로 매출 성장세가 둔화하는 것으로 예측된다”면서 “이번에 진행될 백토서팁과의 병용임상 데이터가 긍정적으로 도출된다면 앞으로 글로벌 제약사로의 대규모 라이선스-아웃(기술수출)을 기대해 볼 수 있다”고 분석했습니다.
백토서팁은 표적항암제, 화학항암제와의 병용에서도 가치를 입증했다는 평가가 나옵니다.
이번에 진행된 미국임상종양학회(ASCO)에서 표적항암제 글리벡 병용 1b상(데스모이드 종양)과 화학항암제 파클리탁셀 병용 1b상(전이성 위암)의 데이터가 발표됐습니다. 글리벡 병용임상의 경우 외과적 수술이나 방사선 치료가 듣지 않은 7명의 데스모이드 종양 환자를 대상으로 약 5~8개월간 진행했는데, 저용량(백토서팁 100㎎)에서는 ORR 28.6%, 안정 병변(SD) 28.6%, 고용량(백토서팁 200㎎)에서는 SD 42.8%의 결과가 도출됐죠.
김 연구원은 “일반적인 데스모이드 종양 치료 기간이 1년 이상이며, 글리벡 단독투여 시의 평균적인 ORR 11~13% 역시 12개월 임상 데이터임을 고려했을 때 ASCO에서 발표된 저용량 백토서팁+글리벡 병용 임상 ORR인 28.6%는 유효성에 대한 매우 긍정적인 수치로 판단한다”고 강조했습니다.
그는 이어 “기존에 진행됐던 다른 데스모이드 종영 임상의 경우 부작용으로 중도 탈락한 환자가 많았다”며 “데스모이드 종양 임상에서 안전성 확보는 매우 중요한 지표인데, 백토서팁의 경우 용량제한독성 반응은 나타나지 않았으며 부작용의 대부분은 근육통(57.1%), 피로감(42.8%) 등으로 안전성을 확보했다”고 덧붙였습니다.














![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)
![[포토]아침 영하 10도, 꽁꽁 얼어붙은 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300843t.jpg)
![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)


![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


