|
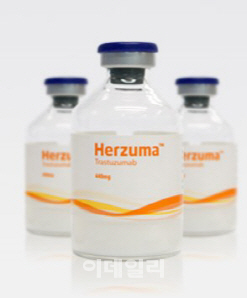
허쥬마는 최근 유럽의약품청(EMA) 약물사용자문위원회(CHMP)로부터 허가승인 권고의견을 받았다. CHMP는 신약 허가 전문가들로 구성된 회의체로 통상적으로는 CHMP 의견을 EMA가 그대로 받아들인다. 이후 유럽연합 집행위원회(EC)가 EMA 의견을 반영해 2~3개월 후 최종 승인을 낸다. CHMP는 오리지널약인 ‘허셉틴’의 모든 적응증에 허쥬마를 쓸 수 있다는 의견을 냈다.
허쥬마가 2~3개월 뒤 유럽에 출시될 경우 이미 유럽에서 허가를 받아 준비 중인 삼성바이오에피스와의 경쟁이 불가피하다. 일각에서는 승자가 시장을 독식하는 바이오시밀러 업계 특성상 허셉틴 바이오시밀러 시장 후발주자인 셀트리온이 삼성바이오에피스에 고전할 것이라는 전망이 있다. 하지만 셀트리온은 ‘기우’라는 입장이다. 셀트리온 관계자는 “첫 바이오시밀러인 램시마의 경우 2013년 10월 허가 이후 경쟁자가 나타날 때까지 2~3년이 걸렸기 때문에 막강한 승자독식 효과를 경험했다”며 “허쥬마는 경쟁사와 불과 3~4개월 차이에 불과해 경쟁사는 램시마 때와 같은 막강한 시장 선점효과는 누리기 어려울 것”이라고 말했다.








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)



