미국 식품의약국(FDA)은 당시 문제의 헤파린 제조에 사용된 중국산 수입 원료에서 `과황산화 콘드로이틴황산(OSCS : oversulfated chondroitin sulfate)`이라는 오염물질이 포함된 사실을 밝혀냈다.
그러나 사망사고가 발생한 지 2년이 지났지만 FDA는 헤파린의 원료가 어떠한 경로로, 왜 오염됐는지 등에 대한 구체적인 원인을 규명하지 못했다.
지난 4월30일 조 바튼, 마이클 C.버제스 등 2명의 미국 하원의원은 미 국민을 대표해 FDA 책임자인 마거릿 햄버거 박사에게 강력한 항의 서신을 보냈다.
의원들은 FDA가 `헤파린 사망 사건`의 원인을 철저히 규명하는 데 실패했고, 헤파린 원료를 만든 중국 기업에 대해 지속적이고 적절한 조사도 이루어지지 않았다며 FDA를 크게 꾸짖었다.
◇ 인도·중국 미 제네릭 80% 점유 불구, 품질 의구심 증폭
이와 관련해 마크 팩스턴 미 제약협회(PhRMA) 부사장은 최근 중국과 인도에서 생산된 완제의약품(finished dosage form)이나 원료의약품(API)과 관련된 `부정적인` 뉴스에 한국이 귀를 기울이기를 바란다고 말한다.
중국과 인도에서 제조된 제품들의 품질과 안정성이 도마 위에 올라오면서 미국 내 바이어들 사이에 인도·중국 제조시설에 대한 부정적인 시각이 커지고 있다는 이유에서다.
현재 미국에서 판매되는 완전의약품이나 원료의약품의 대부분은 미국 밖에서 생산이 이루어지고 있다. 특히 제네릭(용어)은 FDA가 승인한 완전 및 원료의약품 가운데 무려 81%가 중국과 인도, 두 나라에서 생산되고 있다.
그러나 중국과 인도의 생산시설과 원료의약품 등에 대한 품질문제가 최근 주요한 이슈로 부각되고 있다. 특히 의약품의 품질문제가 발생하면 문제의 책임은 의약품 생산공장이 아니라 약을 판매한 미국 제약회사에 있기 때문에 미국 제약회사들은 요즘 제조시설 품질기준에 매우 민감한 상황이다.
|
더욱이, 헤파린 사건을 계기로 미 식품의약국(FDA)의 조사가 강화되면서, 근래 인도의 랜박시는 물론이고 캐나다의 아포텍스, 미국의 존슨앤드존슨 자회사 맥릴 등 북미지역 의약품 생산공장마저 품질문제로 가동이 중단되는 일까지 빚어져, 의약품 납품 공장에 대한 품질기준 요구가 더욱 강화될 전망이다.
팩스턴 부사장은 "한국이 미국에 수출하는 완제품이나 원료의약품의 규모는 작지만, 기술과 품질 만큼은 뛰어나다는 인식이 있다"며 "한국 제조사들이 인도와 중국을 부정적으로 보는 바이어를 대상으로 신속하게 행동한다면 좋은 사업 기회를 얻을 수 있을 것"이라고 밝혔다.
|
버락 오바마 대통령이 `건강보험 개혁법`에 서명함에 따라 그동안 무보험자였던 3200만명에 달하는 미국인이 새로 건강보험에 가입, 미국 국민의 95% 이상이 의료혜택을 받게 되었다. 이에 따라 미국의 의약품시장은 건강보험 가입이 의무화되는 2014년부터 크게 성장하리라는 분석이다.
합성의약품(용어) 역시 건보 개혁의 영향으로 오리지널(용어)은 물론이고 제네릭 의약품 수요가 동시에 증가할 전망이다. 특히 현재 미국 FDA에 허가신청되는 의약품의 70%가 제네릭이고, 값비싼 오리지널보다 저렴한 제네릭을 선호하는 미국인이 80%에 달하고 있어 제네릭 시장은 더 크게 성장하리라고 관측된다.
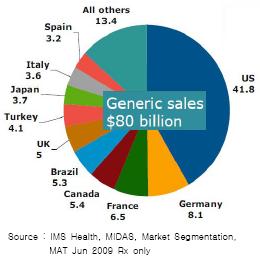
현재 전 세계 제네릭 시장의 규모는 연간 800억달러에 달하고, 이 가운데 미국은 절반이 넘는 420억달러 규모의 커다란 시장을 갖고 있다.
이런 가운데 블록버스터 오리지널 의약품의 특허권 만료가 2011년부터 2013년 사이에 집중적으로 몰려 있다. 공교롭게도 블록버스터 의약품들의 특허 만료가 몰린 시점에 미국의 건보 개혁이 자리 잡고 있어, 향후 수년간 세계 제네릭 시장은 비약적인 성장을 거듭할 것으로 예상된다.
실제 2013년까지 특허가 만료되는 블록버스터 의약품의 전 세계 시장규모는 1370억달러에 달한다. 또 브랜드 약품 특허 만료에 따라 미국에서만 2003년부터 2013년까지 10년간 910억달러의 달하는 새로운 제네릭 시장이 형성될 것으로 분석되고 있다.
◇ 한국산 제네릭의약품, 미국 진출실적 거의 `전무`
그러나 한국산 제네릭 의약품의 미국진출 실적은 거의 전무한 상태이다. 유통라인 미확보, 제조물책임법에 의한 배상 가능성, 비교 우위 제네릭 품목 미확보, 낮은 가격경쟁력, 특허정보 미흡 등 다양한 불확실 요인이 남아 있어 있기 때문이다.
또 미국의 제네릭 의약품 생산방식은 단일라인, 단일 제품의 대량생산체제이지만, 한국은 소량생산 방식이어서, 미국 FDA 현장 실태조사에 한국 기업들이 부담마저 느끼고 있는 실정이다.
한국보건산업진흥원 뉴욕지소장인 조도현 박사는 "우리나라 제약산업이 제네릭 위주였음에도 제네릭 의약품조차 미국시장에 진출하지 못한 것은, 여러가지 원인이 있지만 가장 큰 이유는 품질문제와 비용문제를 해결하지 못했기 때문일 것"이라고 밝혔다.
◇ 비집고 들어갈 틈새는 많다...자신감 갖고 美 제네릭 공략해야
그러나 한국 제약업체들이 연구와 준비를 철저히 한다면 한국 역시 미국 제네릭 시장에서 선전할 가능성은 충분한다. 앞서 지적했듯이 가격경쟁력만 앞세워 시장을 점유해온 중국과 인도는 생산시설과 현지 생산 의약품 품질문제가 주요한 이슈로 부각된 상태다.
이에 따라 한국에서 생산되는 완제의약품과 원료의약품 품질에 대한 우수성이 확보되면 미국시장 진입 가능성이 크다. 물론 이를 위해서는 엄격한 품질확보가 선행돼야 하며, 올 1월 한국 식품의약품안전청이 밸리데이션(Validation)(용어) 등을 전면 실시한 점은 긍정적으로 평가된다.
이처럼 품질개선 노력과 더불어 한국의 고비용 구조에서도 충분한 이윤을 남길 수 있는 퍼스트 제네릭(first to file)(용어) 이나 제품화 기술이 요구되는 개량 신약(용어) 등을 `속도감` 있게 개발하면 구체적인 성과를 거둘 수 있다는 분석이다.
미국 컨설팅업체 파머슈티컬 어드바이저스의 김민우 박사는 "한국의 비용구조로는 인도와 중국과 경쟁할 수 없다는 생각하는 사람들이 많지만, 제넥릭 스페셜티(specialty) (용어)쪽을 들여다보면 그렇지 않다"고 밝혔다. 신약과 마찬가지로 스페셜티 분야에서도 인도와 중국 업체들을 찾아볼 수 없다는 것이다.
김 박사는 따라서 "한국의 제네릭 업체들이 인도와 중국과의 경쟁이 거의 없는 스페셜티 쪽으로 가야 한다"고 조언하고 아울러 "이런 분야에서 한국업체가 경쟁하려면 결국은 기술개발에 집중해야 한다"고 강조했다.
SK생명과학 미국법인의 신헌우 부장(유기화학 박사)은 "제네릭에서 물량으로 승부하기 어려울 것이라는 점에 동의한다"며 "승인된 제네릭(authorized generic)(용어)에 대한 (다국적 제약사들로부터의) 위탁생산에 관심을 두면 어떨까 싶다"고 말했다. 물론 이를 위해서는 다국적 제약들과의 긴밀한 협조가 필요할 것이라고 설명한다.
신 박사는 또 혈압약인 노바스크(Norvasc)와 고지혈증 치료제인 리피토를 결합한 카듀엣(Caduet)을 만든 예처럼 제레릭 컴비(generic combination) 등 단순 제네릭에서 탈피해 부가가치를 추가하는 식의 다양한 방법을 전략적으로 찾아야 한다고 조언했다.
미국 메이저 제약사에 근무 중인 김 모 박사(제약사 규정상 익명 처리)는 "한국 제네릭업체들이 가격경쟁력을 극복하려면 퍼스트 제네릭의 신속한 개발과 같은 속도(speed), 그리고 품질이 중요하다"고 주문했다. 그는 여기에다 "정부와 보험사 등의 약값 인하 요구를 상대할 수 있는 협상 인력을 확보하고, 세계 추세에 맞춰 (인수·합병을 통해) 좀 더 규모 있는 사업을 전개하라"고 덧붙였다.
◇용어
▲제네릭의약품 = 합성의약품의 복제의약품.
▲합성의약품 = 화학적 방법으로 제조하는 의약품
▲오리지널의약품 = 최초로 출시돼 특허권을 보장받는 의약품.
▲밸리데이션(Validation) = 제조공정 및 시설이 올바르게 작동하고 있는지를 체계적으로 조사?검토?확인하여 문서화하는 작업
▲퍼스트 제네릭 = 오리지널 의약품의 특허 만료 후 처음 등록하는 합성의약품의 복제의약품
▲개량신약 = 오리지널 의약품의 화학구조 변형, 제제구조 개선을 통해 임상효능이 향상된 의약품
▲스페셜티 = 1차 치료(Primary care) 의약품에 대별되는 개념으로 특수질환을 위한 치료제
▲승인된 제네릭(authorized generic) = 오리지널 의약품사에서 제조한 복제의약품








![[포토]양 극단의 집회로 마비된 한남동](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010500313t.jpg)
![[포토]서울 설경을 휴대폰에 담아요](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010500239t.jpg)
![[포토]기름값 12주 연속 상승, 국제유가-환율 인상 영향](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010500220t.jpg)
![[포토] 평창송어 얼음낚시](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010301047t.jpg)
![[포토]윤 대통령 체포 실패하고 이동하는 공수처](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010300843t.jpg)
![[포토] 서울광장 스케이트장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010300711t.jpg)
![[포토]윤석열 대통령 지지자 시위](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010300591t.jpg)
![[포토]공수처 도착한 오동운 공수처장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010300320t.jpg)
![[포토]공수처와 경찰, 윤 대통령 관저 정문 통과](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010300246t.jpg)
![[포토]윤 대통령 지지자 강제 해산하는 경찰](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010201153t.jpg)

![[포토] 메디힐 골프단 '최정상급 수준의 계약으로 최강 골프단 등극'](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25010300073h.jpg)


