|
유전병은 ‘고칠 수 없는 병’이라는 인식이 강했지만 최근에는 이를 치료하기 위한 기술이 개발되고 있습니다. 바로 DNA 염기를 마음대로 자르고 붙이는 ‘유전자가위’가 그 주인공입니다. 이름은 가위이지만 진짜 날이 있는 가위로 유전자를 잘라내는 것이 아니라, 유전자를 자를 수 있는 단백질(효소)을 활용하는 것입니다.
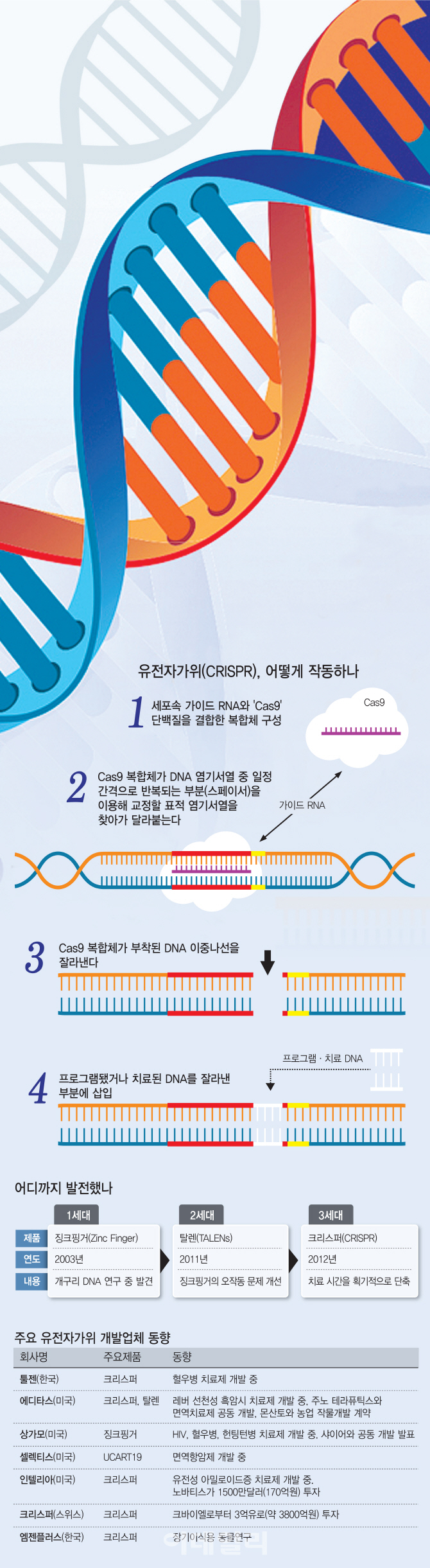
2003년 개발한 1세대 유전자가위는 개구리 DNA에 결합한 단백질을 이용, 유전자를 변형할 수 있도록 만든 ‘징크 핑거 뉴클레아제’(ZFN)입니다. 앞서 1985년 아프리카 발톱개구리 유전자를 연구하던 과학자들이 개구리 DNA에 결합한 단백질을 발견했을 때, 손가락 모양의 고리가 개구리 유전자에 단단히 붙은 형태였습니다. 그리고 그 중심에 아연(Zn) 이온이 있었기 때문에 ‘아연손가락’(징크핑거)이라고 이름을 지은 것이 시초입니다. 그러나 당시 유전자가위는 잘라야 하는 염기서열을 인식하는데 한계가 있고 건당 가격이 5000달러(약 562만원)로 비싼 것이 단점이었습니다. 2세대 유전자가위는 2011년 나온 ‘탈렌’(TALEN)입니다. 개구리에서 유래한 1세대와 달리 식물성 병원체인 ‘잔토모나스’에서 발견했습니다. 탈렌은 1세대보다 더 정밀했습니다. 하지만 크기가 커서 세포 안에 집어넣는 것이 어렵다는 한계가 있었습니다.
그래서 나온 것이 기존 1·2세대보다 정확도와 효율성을 획기적으로 개선한 3세대 유전자가위 ‘크리스퍼’(CRISPR)입니다. 기존 1·2세대는 인공 유전자를 수천개 이상 집어넣으면서 절단용 단백질을 만들어야 했습니다. 또 1·2세대는 단백질을 이루는 구조도 워낙 길어 짧은 염기서열을 자르려면 수천 개의 가위로 DNA를 새로 이식해야 했고, 그 과정에서 정확성이 떨어졌습니다.
2012년 미국 캘리포니아버클리대(UC버클리) 연구팀이 크리스퍼와 ‘캐스나인’(Cas9)이라는 효소를 이용해 염기서열 일부를 잘라낼 수 있는 방법을 발견하면서 본격적인 3세대 유전자가위 시대가 열렸습니다. 크리스퍼는 1·2세대 유전자가위가 설계에만 수개월이 걸리고 가격이 비싸 대중화가 어렵다는 단점을 단번에 해결했습니다. 하루 정도면 설계가 끝나고 비용도 100만원 이하입니다.
3세대 크리스퍼는 등장과 함께 전 세계의 주목을 받았습니다. 어떤 연구자는 ‘연구 민주화’라고도 표현할 정도입니다. 세계적인 학술지 사이언스는 크리스퍼를 ‘2015년 올해의 혁신기술’로, 과학전문잡지인 MIT테크놀로지리뷰는 ‘2016년 10대 기술’로 선정하기도 했습니다. 생명공학정책연구센터가 발간한 ‘글로벌 크리스퍼 시장 현황 및 전망’에 따르면 크리스퍼 시장은 2014년 2억달러에서 2022년 23억달러로 8년새 11배 정도 성장할 것으로 예상됩니다.
유전자가위가 질병 치료에만 쓰이는 것은 아닙니다. 연구가 활발한 다른 분야는 농업과 목축업입니다. 특정 물질이 많이 든 기능성 식물, 유전자 조작을 하지 않아도 병충해에 강한 식물, 빨리 자라는 소나 돼지 등도 유전자가위로 만들 수 있습니다. 농업 및 목축업 분야에서 원하는 특성이 나타나도록 만드는 종자개량은 지금까지는 여러 세대를 거쳐야 하기 때문에 시간이 오래 걸렸습니다. 하지만 유전자가위를 이용하면 이 종자개량에 걸리는 시간이 필요 없어집니다. 또 멸종한 생물을 되살리는 것도 가능합니다. 매머드의 DNA를 코끼리 줄기세포에 삽입해 메머드를 복원하는 연구가 현재 진행 중입니다.
하지만 유전자가위는 그야말로 아직 상용화하지 않은 ‘미래기술’입니다. 실험도 대부분 세포 수준에서 진행하다가 쥐 같은 소형 동물로 확대하는 수준입니다. 가장 최근에 나온 연구결과가 근육병을 가진 개를 유전자가위를 이용해 치유한 정도입니다. 유전자가위를 인류 발전을 위해 쓰기 위해서는 넘어야 할 산이 있습니다. 바로 ‘맞춤형 아기’에 대한 윤리 문제입니다. 2015년 미국 하버드대가 유방암과 난소암과 관련 있는 ‘BRCA1’ 유전자 돌연변이가 있는 여성의 난소를 채취, 배양한 뒤 BRCA1 변이 유전자를 정상 유전자로 대체하려는 시도가 공개됐습니다. 같은 해 중국에서는 인간 배아를 이용해 빈혈 유전자를 정상 유전자로 대체하려는 연구가 진행되기도 했습니다. 이런 연구들이 공개되면서 과학자들 사이에서는 ‘안전성이 완전히 밝혀지지 않은 상황에서 성급한 연구다’ ‘윤리적으로 옳지 않다’는 등의 논란이 일고 있습니다. 우리나라에서도 ‘생명윤리 및 안전에 관한 법률’(생명윤리법)을 두고 유전자가위 연구에 대한 논의가 이어지고 있습니다.








![[포토]점등 앞둔 사랑의 온도탑](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100312t.jpg)
![[포토]박찬대 “감액 예산안, 법정시한인 내일 본회의 상정”](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100294t.jpg)
![[포토]짙은 안개에 갇힌 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100227t.jpg)

![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)




!["양육은 예스, 결혼은 노" 정우성 사는 강남 고급빌라는[누구집]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120100093h.jpg)