|
혈액암 이중항체 4종 승인...2030년 관련시장 149조원
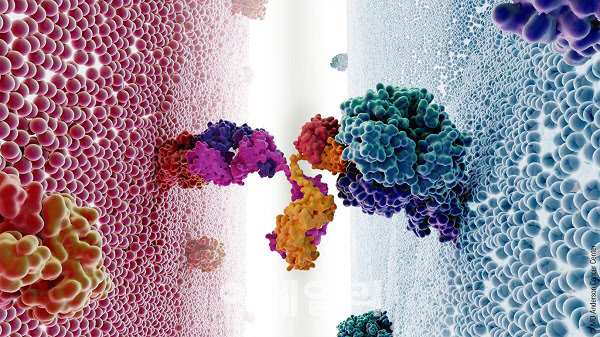
12일 제약바이오 업계에 따르면 최근 이중항체 신약이 혈액암 분야에서 두각을 보이고 있으며, 그 대표 질환 중 하나가 바로 난치성 다발성골수종이다. 기존의 경구약이나 단일항체 약물이 1~3차 단계 초기 치료 단계에서 쓸 수 있도록 개발됐지만, 재발로 인한 후기 치료 옵션의 필요성이 높은 상황이다.
그런데 지난 8월 미국식품의약국(FDA)와 유럽의약품청(EMA)가 미국 얀센이 개발한 탈베이(성분명 탈쿠에타맙)를 재발·불응성 다발성 골수종 대상 5차 치료제로 차례로 승인했다. 탈베이는 T세포 표면의 CD3 수용체와 혈장세포 GPRC5D에 동시에 결합하는 이중특이항체로 해당 기전을 가진 최초 신약이다.
같은달 미국 화이자가 개발한 이중항체 신약 엘렉스피오도 FDA로부터 탈베이와 같은 적응증으로 승인받았다. 엘렉스피오는 B세포성숙항원(BCMA)와 CD3를 동시에 잡는 이중항체다.
이외에도 얀센은 미국과 유럽 등에서 지난해 2~3월 사이 CAR-T치료제 ‘카빅티’를 다발성골수종의 4차 이상 치료제로 승인받은 바 있다. 사실상 다발성 골수종 후기 치료시장을 얀센이 주도할 것이란 평가가 나오는 이유다.
다발성 골수종 치료제 개발 업계 관계자는 “이중항체가 다발성골수종 뿐만 아니라 난치성 혈액암 적응증을 다변화하기 시작했다”며 “혈액을 떠도는 혈액암 세포 표면의 주요 항원을 타깃하는 항체만 잘 발굴하면 이를 잡아내기 더 쉽다. 주요 항원 2개를 동시에 포획하는 이중항체가 주목받는 이유다”고 말했다.
실제로 지난달 미국 애브비가 개발한 ‘엡킨리’(엡리코타맙)이 주요 난치성 혈액암인 재발 불응성 미만성 거대 B세포 림프종 대상 최초 피하투여 방식의 이중항체 치료제로 EMA로부터 조건부 허가를 획득했다. 해당 약물은 지난 5월 같은 적응증으로 미국에서도 승인됐다.
|
이중항체 개발 주도하는 국내 기업 3사는?
국내 항체 전문 바이오텍도 이중항체 플랫폼과 후보물질 확보에 열을 올리고 있다. 먼저 종근당(185750)이 첫 바이오신약 개발 시도의 일환으로 폐암 대상 이중항체 신약 후보 ‘CKD-702’의 국내 임상 1상을 지난해 9월 성공적으로 마친 것으로 알려졌다. CKD-702는 ‘간세포성장인자 수용체’(cMET)와 ‘상피세포성장인자 수용체’(EGFR)를 동시에 타깃한다. 현재 CKD-702의 2상을 진행 중이며, 해당 임상은 내년 말까지 완료되는 것으로 설계됐다. 회사 측은 기존 표적항암제의 내성을 극복할 수 있는 퍼스트인 클래스 약물이 될 것으로 기대하고 있다.
또 CAR-T 개발사로 알려진 앱클론은 이중항체 개발 플랫폼 ‘어피맵’을 확보했으며 이를 통해 관련 후보물질 ‘AM201’(류마티스관절염 대상), ‘AM105’(대장암 등 고형암 대상)을 확보해 전임상 연구를 수행하고 있다. 다중표적 항체개발 플랫폼 ‘DIG-XY’를 보유한 파멥신은 안과질환 적응증을 노리는 이중항체 2종(PMC-291, PMC001)과 고형암 대상 삼중항체 ‘PMC-122’ 등의 발굴 단계 연구를 수행하고 있다.
이중항체 개발 업계 관계자는 “글로벌 기업과 국내 이중항체의 기술력 자체는 거의 격차가 없다. 자금적인 차원에서 선제적으로 크게 투자한 빅파마가 성과를 내고 있다”며 “기술수출이나 파트너사 발굴 등을 통해 임상 개발의 동력을 유지한다면 국내 바이오텍의 물질도 충분히 최종 개발 관문을 뛰어넘을 수 있을 것”이라고 자신했다.
이밖에 에이비엘바이오(298380)도 이중항체 플랫폼 및 신약 후보물질 7종을 확보한 것으로 알려졌다. 에이비엘 바이오 관계자는 “7종 중 4종은 우리가 직접, 나머지 3종은 기술수출을 통한 파트너사가 임상을 주도하고 있다”고 전했다.










![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)

![강 건너고 짐도 나르고…‘다재다능’ 이상이의 무한변신 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24113000131h.jpg)

![선도지구 탈락 지역, 행정소송 가능할까?[똑똑한 부동산]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24113000125h.jpg)