내년, 바이오시밀러 매출 본격화
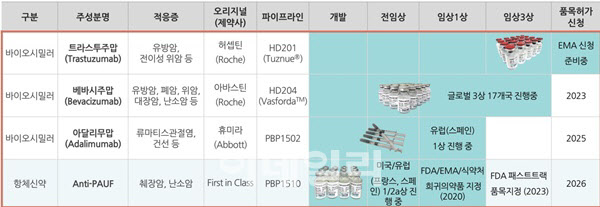
허셉틴 바이오시밀러 HD201의 품목허가는 프레스티지바이오파마(950210)의 바이오시밀러 사업 흥행 여부를 점칠 수 있는 첫 단추가 될 수 있다는 점에서 세간의 주목을 받고 있다. 지난해 9월 유럽의약품청(EMA) 품목허가 자진철회 후 약 10개월만의 재도전에서 허가 가능성이 상당히 높다는 게 회사 측 설명이다.
HD201은 지난해 3월 임상 3상 최종 결과보고서(CSR)를 통해 오리지널 의약품과의 높은 생물학적 유사성을 입증했다. 이를 바탕으로 올해 1월 임상 완성 SCI급 논문 ‘BMC’를 발표했고, 품목허가 신청을 목전에 두고 있다. 현재 유럽 포함 세계 42개국 라이선스 계약을 완료한 상태다. 특히 유럽 품목허가를 획득하면 곧바로 미국 품목허가도 추진하게 된다.
|
허셉틴 바이오시밀러를 이을 캐시카우 제품인 아바스틴 바이오시밀러 HD204도 상업화에 시동을 건다. 2019년 호주 임상 1상을 통해 약동학(PK) 및 안전성에서 아바스틴과 우수한 동등성을 입증했다. 여기에 최적화된 정제방법, 항체 생산 및 정제방법 관련 3개 특허를 25건 등록해 차별화된 경쟁력을 장착했다. 현재 한국(휴온스)과 미국, 유럽, 러시아 지역 라이선스 계약을 완료했다. 내년 초 미국 식품의약국(FDA)과 유럽서 품목허가 신청에 나설 계획이다.
세계 의약품 시장 매출액 1위인 휴미라 바이오시밀러 개발도 본격화되고 있다. 회사 관계자는 “2022년 1월 스페인에서 임상 1상을 승인받아 진행 중에 있고, 지난 2월에는 헝가리 임상 1상을 승인받았다”며 “올해 1상에서 안전성 확인 후 글로벌 임상 3상을 개시할 예정이고, 2025년 유럽과 미국 품목허가 신청을 목표로 하고 있다”고 설명했다.
13조 췌장암 조기진단 시장 선점 자신
박 회장은 “췌장암 조기진단은 환자가 아닌 일반 사람들에 대한 니즈가 핵심이다. 췌장암에 걸리지 않은 일반 사람들이 향후 암 발병 확률에 대해 알고 싶어하는 니즈가 높다”며 “현재까지 상용화된 췌장암 조기진단키트는 없으며, 췌장암에 특이적으로 반응하는 바이오마커는 당사의 PAUF가 유일하다. 이를 통해 조기진단키트를 개발하고 있다”고 말했다.
시장조사기관 글로벌마케터스비즈에 따르면 췌장암 진단 시장은 2019년 29억5000만 달러(약 3조5000억원)에서 연평균 6.2% 성장해 2026년 34억9100만 달러(약 4조1000억원) 규모로 성장할 것으로 전망된다. 하지만 이는 환자들을 대상으로 한 시장일 뿐 일반인까지 대상을 넓히면 시장 규모는 약 13조원에 달한다는 게 회사 측 설명이다.
프레스티지바이오파마는 최근 조기진단 임상시료 분석에서 췌장암 환자에서 PAUF 수치가 정상인 대비 2배 높은 것을 확인했다. 특히 췌장암 조기진단키트는 혈중 PAUF를 높은 민감도 및 특이도로 검출할 수 있다. 바이오 마커 민감도분석에 사용되는 ROC 분석에서도 86.3%의 높은 민감도를 보인바 있다. 그는 “PAUF 단백질을 검출하는 조기진단키트로 췌장암을 미리 진단하고, 암세포 증식 및 성장을 억제하는 췌장암 항체 신약 PBP1510으로 치료하는 췌장암 치료 원스톱 솔루션 체계를 완성해 환자 생존율을 높일 것”이라고 강조했다.








![[포토]의정갈등에 피해는 환자에게…](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200764t.jpg)
![[포토]사랑의열매, '희망2025나눔캠페인' 시작… 목표액 4497억원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200776t.jpg)
![[포토] 서울 중장년 동행일자리 브랜드 선포](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200708t.jpg)
![[포토]'본회의장 향하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200677t.jpg)
![[포토]표정 어두운 우원식 국회의장, '오늘 예산안 상정 안 해'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200559t.jpg)
![[포토] 화학물질저감 우수제품 발표하는 이병화 환경부 차관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200532t.jpg)
![[포토]교보생명 광화문글판, 유희경 시인 ‘대화’로 새단장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200500t.jpg)
![[포토]우정사업본부, 2025 연하우표 발행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200431t.jpg)
![[포토]비상의원총회, '대화하는 추경호-조정훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200384t.jpg)
![[포토]최상목 "野 감액안 허술한 예산…무책임 단독 처리 깊은 유감"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200344t.jpg)




