[시카고=이데일리 김지완 기자] ‘100%’. 앱클론(174900)의 CAR-T 치료제 AT101가 임상 1상에서 중·고용량 투약군에서 기록한 객관적반응률(ORR)이다.
|
윤덕현 서울아산병원 CAR-T센터장(교수)은 5일(현지시간) 미국 시카고에서 열린 미국임상종양학회(ASCO)에서 앱클론의 CAR-T 치료제 ‘AT101’의 임상 1상 최종 결과를 발표했다.
이날 이데일리는 미국 시카고에서 열린 ASCO 포스터 발표 현장을 찾아 AT101의 임상을 총괄했던 윤 교수를 인터뷰했다.
“AT101 ORR 100%,,.킴리아도 50%에 불과”
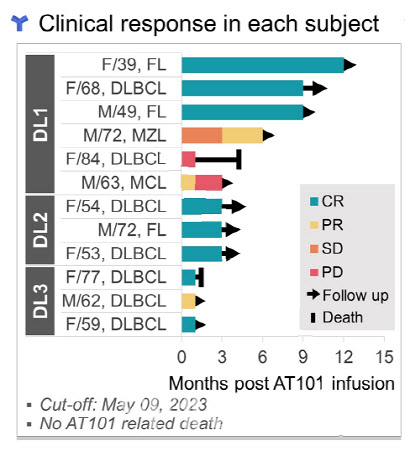
윤 교수는 “킴라아가 임상 2상 후 객관적반응률이 50% 수준”이라면서 “이에 비해 AT101은 중·고용량에선 100%, 저용량까지 합산해도 91.7%로 우수한 효능을 나타냈다”고 비교했다.
앱클론은 총 12명의 혈액암 환자들을 대상으로 AT101 임상 1상을 진행했다. AT101 임상 1상은 저용량군 6명에게 T세포를 몸무게 ㎏당 20만개를 주입했다. 3명의 중용량 투여군은 100만개, 3명의 고용량 투여군엔 500만개 순으로 투입량을 늘렸다.
이 임상에서 암세포가 말끔하게 완전히 완전관해(CR) 환자만 8명이다. 완전관해 비율은 66.7%에 달한다. 나머지 4명 중 2명은 부분관해(PR)다. 부분관해는 암세포가 치료 전보다 30% 이상 줄어든 것을 말한다.
“1상 결과 예상대로...기존 치료제보다 뛰어나”
윤 교수는 “AT101은 상업화된 CAR-T 치료제보다 암세포 결합부위가 가깝고 인간화 항체를 사용하기에 약 효능이 좋을 것으로 기대했다”면서 “이러한 기대가 임상 1상 결과로 나온 것”이라고 말했다,
킴리아, 예스카다, 테카투스, 브레얀지 등 상용화된 CAR-T 치료제는 모두 CD19 항원을 표적으로 삼고 있다. 문제는 이들 치료제는 모두 같은 항체 결합부위를 사용한다. 반면 AT101은 기존 CAR-T 치료제와 CD19 결합(에피토프) 위치가 다르다. 구체적으로 AT101은 기존 CAR-T 치료제보다 암 세포 가까이 결합하면서 치료 효능이 높게 나온다. 아울러 킴리아는 예스카다, 테카투스, 브레얀지 등과 동일한 치료제다. 즉, 킴리아 불응환자에게 여타 다른 치료제를 투약할 수 없지만 AT101은 투약이 가능하다는 얘기다.
지금까지 승인된 글로벌 CD19 표적 CAR-T 치료제는 모두 마우스 유래 FMC63 항체를 사용하고 있다. 앱클론은 세계 최초로 h1218 인간화 항체를 사용한다.
|
“고용량 투여하는 2상 결과 기대”
AT101의 투약 예후도 무척 좋다. 초기에 투약한 저용량 투여군 가운데 1명은 12개월 이상 완전관해를 유지 중이다. 또 다른 2명의 저용량 투여 환자도 9개월 이상 완전관해를 이어가고 있다. 환자 1명은 6개월간 안정병변을 거쳐 부분관해가 나타나는 등 상태가 호전되고 있다.
윤 교수는 “이분들 모두 아산병원 환자들로 내가 돌보고 있다”며 “투약 1년이 지났는 데도 불구하고 재발없이 아주 잘 지내고 있다”고 말했다.
AT101은 안전성에도 합격점을 받았다. 그는 “임상 1상에서 가장 주된 점은 안전성”이라며 “AT101은 예상치 못한 부작용이 없었다. 전체적으로 굉장히 양호한 안전성 값을 보여줬다”고 말했다.
윤 교수는 “오늘 새벽 AT101 임상 2상 투약용량을 몸무게 ㎏당 500만개의 T세포를 주입하는 것으로 결론냈다”면서 “중·고용량 투약환자 100%에서 반응이 나온 만큼 AT101 임상 2상을 기대해도 좋다”고 말했다.
한편, 앱클론은 AT101의 이 같은 임상 성과로 보스턴에서 열리는 바이오USA에서 20건 이상의 기술수출 미팅을 진행할 예정이다.









![[포토]표정 어두운 우원식 국회의장, '오늘 예산안 상정 안 해'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200559t.jpg)
![[포토] 화학물질저감 우수제품 발표하는 이병화 환경부 차관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200532t.jpg)
![[포토]교보생명 광화문글판, 유희경 시인 ‘대화’로 새단장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200500t.jpg)
![[포토]우정사업본부, 2025 연하우표 발행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200431t.jpg)
![[포토]비상의원총회, '대화하는 추경호-조정훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200384t.jpg)
![[포토]최상목 "野 감액안 허술한 예산…무책임 단독 처리 깊은 유감"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200344t.jpg)


![[포토]12월 LPG 국내 프로판 가격 인상](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100332t.jpg)
![[포토]초코과자 가격 상승](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100324t.jpg)




