LG화학(051910)이 개발 중인 경구용 통풍치료제 ‘티굴릭소스타트(Tigulixostat)’가 기존 치료제 대비 낮은 부작용과 뛰어난 효능으로 시장과 의료계의 관심을 받고 있다. LG화학은 이달 들어 글로벌 시장 진출을 위한 최종 임상 단계에 착수했다.
21일 업계에 따르면 LG화학은 이달 초 통풍치료제 ‘티굴릭소스타트’ 두 번째 임상 3상 계획을 미국 식품의약국(FDA)에 신청했다. 앞서 위약군(가짜약)과 비교하는 임상 계획을 신청했고 이번에는 1차 치료제 성분인 ‘알로푸리놀(Alopurinol)’과 비교하는 임상 계획을 추가로 신청했다. 이어 중국과 스페인 규제당국에도 임상 3상 계획을 신청했다.
|
현재 통풍 1차 치료제로 쓰이는 알로푸리놀의 경우 피부이상반응과 어지러움, 졸음 등 부작용이 있어 유전자 검사 없이는 처방을 받기 어렵다. 티굴릭소스타트의 강점은 안전성에 있다. 경쟁 개발사들도 부작용을 낮추는데 초점을 맞추고 있다. 지금까지 데이터는 긍정적이다. 미국 임상 2상 결과 신속하고 강력한 요산 강하 효과는 물론이고, 위약군(가짜약)과 유사한 수준의 안전성이 입증됐다는게 LG화학의 설명이다.
티굴릭소스타트는 통풍의 주요 원인인 요산을 만드는 효소 ‘잔틴 옥시다제(XO, Xanthine Oxidase)’의 발현을 억제한다. 지난달 FDA에 신청한 위약 대조군 비교 시험은 미국을 포함한 다국가 지역 고요산혈증 동반 성인 통풍 환자 350명을 대상으로 복용 6개월째 약물의 유효성과 안전성을 평가할 계획이다. 1차 평가 지표는 6개월째 혈청요산농도 6mg/dL에 도달하는 환자의 비율로 설정했다.
|
미국과 유럽 등 고요산혈증 동반 성인 통풍 환자 2600여명을 대상으로 12개월 장기 복용 안전성과 유효성을 평가할 계획이다. 마찬가지로 1차 유효성 평가지표는 복용 4·5·6개월째 측정한 혈청요산농도가 모두 6mg/dL 미만인 환자 비율로 설정했다.
손지웅 LG화학 생명과학사업본부장은 “글로벌 경쟁력 확보 가능한 임상 전략과 선제적인 상업화 준비를 통해 통풍 치료제 시장에 새로운 전기를 마련하겠다”고 말했다. 오는 2027년 미국 FDA로부터 1차 치료제로 품목허가 승인 획득 후 2028년부터 글로벌 판매에 본격 나설 계획이다.
시장조사기관 ‘코히렌트 마켓 인사이트’의 자료를 보면 글로벌 통풍 치료제 시장은 인구고령화 및 비만인구 증가로 2019년 3조원(26억불)에서 2027년 5조원(43억불) 규모로 확대 될 것으로 예상된다. 미국과 중국의 환자가 절대적이다. 현재 전세계 통풍 진단 환자는 3500만명으로 이 중 미국과 중국의 환자 수는 각각 1000만명, 1400만명으로 추산된다.
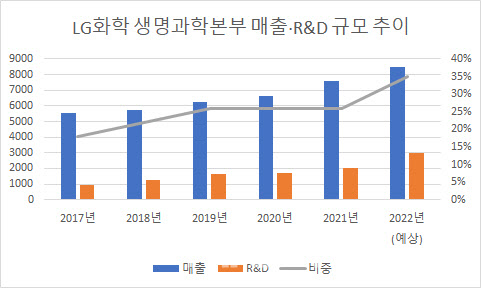
R&D 비중 꾸준히 늘어…올해 매출 대비 35% 전망
LG화학은 통풍치료제 외에도 40여개 신약 파이프라인을 구축해 놓았다. 이중 전임상과 임상단계 신약과제는 20여개다. 12개 신약 파이프라인은 임상 단계를 진행하고 있다.
통풍치료제 외에 시장에서 주목받는 파이프라인은 아토피피부염 치료제 ‘젝티비모드’다. 현재 중국 임상2상을 진행중으로 내년에는 국내를 포함한 다국가 지역서 2상을 본격화한다.
|
LG303174는 지방 합성효소인 DGAT-2 활성을 선택적으로 억제해 간내 지방 축적을 막는 기전의 NASH 신약이다. 현재 미국 1상 단계로 1일 1회 경구 투여로 차별화된 복용 편의성을 제공한다는 목표다. 1일 2회 복용이거나 주사제형으로 개발중인 화이자(PFE) 등 경쟁사 파이프라인 대비 기대를 모으고 있다.
LG화학 관계자는 “내수 및 신흥국 시장 중심의 기존 사업영역을 미국과 유럽 등으로 대폭 확장하기 위해 미국 등에서 직접 임상개발 진행한다는 전략”이라며 “현재 통풍과 희귀비만, NASH, 당뇨 신약 등 임상단계 진입한 파이프라인 5개의 미국 임상개발을 직접 진행 중이다. 글로벌 임상 지속 확대에 따라 연구개발 투자도 확대할 예정”이라고 말했다.










![[포토]우정사업본부, 2025 연하우표 발행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200431t.jpg)
![[포토]비상의원총회, '대화하는 추경호-조정훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200384t.jpg)
![[포토]최상목 "野 감액안 허술한 예산…무책임 단독 처리 깊은 유감"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200344t.jpg)


![[포토]12월 LPG 국내 프로판 가격 인상](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100332t.jpg)
![[포토]초코과자 가격 상승](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100324t.jpg)
![[포토]점등 앞둔 사랑의 온도탑](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100312t.jpg)
![[포토]박찬대 “감액 예산안, 법정시한인 내일 본회의 상정”](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100294t.jpg)
![[포토]짙은 안개에 갇힌 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100227t.jpg)



![삼성전자, 4거래일 연속 하락…5만3000원대 사수 안간힘[특징주]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120200408h.jpg)
