|
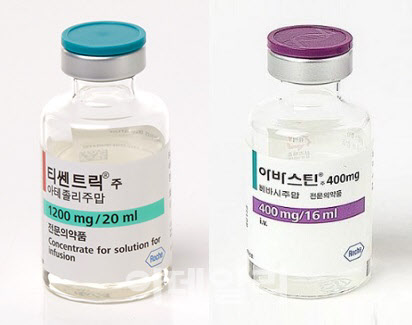
티쎈트릭+아바스틴 요법...간세포암 1차 최우선 옵션 등극
지난 3월 미국임상종양학회(ASCO)는 자국 내 국립종합암센터네트워크(NCCN) 가이드라인 개정을 통해 간암 1차 치료 옵션에 티센트릭과 아바스틴의 병용요법을 최우선 순위로 사용할 것을 권고했다. 두 약물의 병용요법이 간암 환자 대상 1차 치료제 ‘넥사바’(성분명 소라페닙)보다 우수한 효능을 갖춘 것으로 인정받게 된 것이다. 넥사바는 독일 바이엘이 개발해 2007년 세계 최초로 FDA의 승인을 획득한 간암 치료제다.
지난해 ASCO에서 티센트릭과 아바스틴의 병용요법으로 치료한 환자군의 생존 기간은 넥사바보다 34% 가량 긴 19.2개월로 나타났다. 완전관해(완치율) 역시 7.7%로 넥사바의 완전관해율(0.6%) 대비 큰 폭으로 개선된 연구 결과가 확인됐다. 절제 불가능한 중증 간암 환자 79명을 대상으로 국내에서 진행된 한 임상 연구에서도 두 약물 병용요법의 6개월 차 생존률이 80.7%로 높게 집계됐다.
사실상 티세트릭과 아바스틴 등 병용요법이 간암 치료의 새로운 패러다임으로 작용하고 있다는 평가가 이어진 이유다. 유럽종양학회(ESMO)도 이 치료법을 1차 치료 시 표준 옵션으로 지정한 바 있다.
로슈의 아바스틴은 결장직장암 치료제로 2004년 FDA와 2005년 유럽의약품청(EMA)의 승인을 받은 단일클론항체다. 이후 각국에서 신세포암, 폐암, 신장암, 난소암 및 나팔관암, 다형성 교모세포종 등의 치료에 두루 쓰였다. 난소암 및 나팔관암 관련 용도 특허을 제외하고 초창기에 획득한 아바스틴 적응증 관련 용도 특허는 모두 만료된 것으로 알려졌다.
최근 아바스틴 바이오시밀러의 등장으로 국내외에서 약가 인하 움직임이 일면서 오리지널의 매출이 크게 떨어졌다. 일례로 국내 아바스틴 100㎎ 기준 1바이알(vial) 가격은 기존 약 33만원에서 약 23만원으로 30% 가량 떨어진 바 있다. 이에 따라 지난해 아바스틴의 세계 매출은 27억9440만 달러(한화 약 3조5630억원)로 2020년(53억 2000만 달러) 보다 대폭 감소했다.
“간암 병용요법이 두 약물 판매량 올릴 수 있어”
이에 대비하기 위해 로슈는 2020년 5월 FDA와 EMA, 식품의약품안전처(식약처)등으로부터 간세포암 1차 치료 대상 티센트릭과 아바스틴의 병용요법 적응증을 승인받았다. 회사가 해당 적응증을 발굴해 FDA로부터 혁신 치료법으로 인정받은 것은 비교적 최근인 2018년이며, 이와 관련한 용도 특허 관련 내용은 공개하지 않고 있다.
식약처에 따르면 아바스틴의 ‘난소암치료를 위한 항혈관 신생 요법 관련 특허’ 관련 3건의 용도 특허가 국내에서 아직까지 효력을 발휘하는 상황이다. 로슈가 FDA로부터 3~4기 난소암 환자에게 아바스틴과 화학요법을 병용하는 적응증을 획득한 건 2018년이다.
지난달 29일 알보젠코리아가 아바스틴의 남은 용도 특허 중 2031년 만료되는 1건의 특허를 무력화할 가능성을 열었다. 특허심판원이 알보젠코리아가 제기한 해당 특허의 무효심판에서 ‘일부성립. 일부 각히’ 심결을 내렸기 때문이다. 하지만 로슈가 이에 항소할 가능성이 높아, 바이오시밀러 개발사들이 난소암 적응증을 뺀 아바스틴 바이오시밀러를 시장에 내놓을 것으로 분석되고 있다.
앞선 관계자는 “물질 특허와 달리 용도 특허의 경우 소송을 통해 극복하는 사례가 간혹 있지만 쉬운 일은 아니다. 한동안 로슈가 난소암, 간세포암 관련 병용요법 적응증으로 아바스틴의 지위를 유지할 수 있을 것”이라고 전망했다.
한편 이미 미국 암젠 ‘엠바시’, 화이자 ‘지라베브’, 알보젠의 ‘아람시스’ 등의 아바스틴 바이오시밀러가 2017년부터 미국과 유럽, 한국 등에서 승인됐다. 국내 삼성바이오에피스의 ‘온베브지’도 지난해 유럽과 한국 등에서 승인을 받았다. 셀트리온(068270)과 프레스티지바이오파마(950210)도 각각 아바스틴 바이오시밀러 ‘CR-P16’과 ‘HD204’를 개발하는 중이다.









![[포토]김세은 아나운서,따스한 햇살 받으며](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111600281t.jpg)
![[포토] 평창고랭지 김장축제](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501303t.jpg)
![[포토] 종로학원, 대입 합격점수 예측 설명회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501114t.jpg)
![[포토]이재명 민주당 대표 '징역 1년에 집행유예 2년'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501110t.jpg)
![[포토]'구속VS무죄' 이재명 공판 앞두고 쪼개진 서초동](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111500881t.jpg)
![[포토] 개인정보보호위원회 기자설명회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111500752t.jpg)

![[포토]고생했어~](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401524t.jpg)
![[포토] 걷고 싶은 거리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401206t.jpg)
![[포토] 광복 80주년 기념사업 시민위원회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401169t.jpg)
![[포토]김세은 아나운서,진행은 매끄럽게](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600282h.jpg)
![[이車어때]"8800만원짜리 드림카"…벤츠 AMG A 45 S 4MATIC+](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600211h.jpg)


![예금자보호한도 24년만에 오른다고?[오늘의 머니 팁]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600304h.jpg)