아울러 엘앤케이바이오의 흉벽기형 임플란트는 오목가슴 뿐 아니라 새가슴과 복합 흉벽기형 환자에게도 사용이 가능한 제품이어서 매출성장에 상당한 기여를 할 것으로 예상된다.
3일 엘앤케이바이오에 따르면 지난주 흉벽기형 임플란트 ‘캐슬락-팩투스’(CastleLoc Pectus Bar System)에 대한 FDA 인허가 신청이 완료됐다.
흉벽기형은 가슴뼈가 안으로 들어가거나 밖으로 지나치게 튀어나오면서 흉곽이 변형되는 질환이다. 크게 오목가슴, 새가슴(볼록가슴), 복합기형가슴 등으로 구분된다. 흉곽 변형은 주로 성장기에 발생하며 명확한 발생 원인이 밝혀지지 않은 희귀 질환에 속한다.
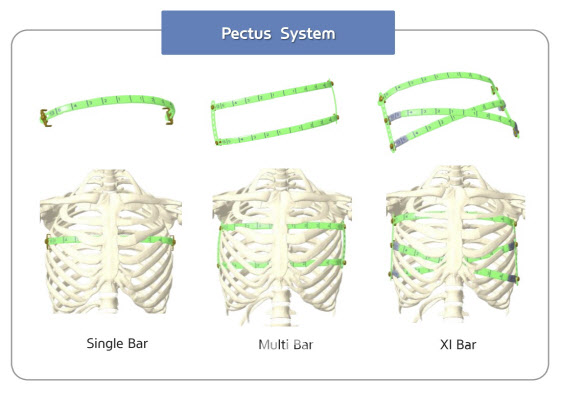
엘앤케이바이오의 신제품 ‘캐슬락-팩투스’는 가슴 흉골 아래에 구부러진 금속 막대(Bar)를 삽입해 가슴 뼈를 올바른 위치로 교정하는 흉벽기형 임플란트다. 제품을 X자 또는 XI 형태로 겹쳐 각 바를 연결하는 브릿지 플레이트를 통해 고정할 수 있다. 이에 전세계적으로 유일하게 새가슴(볼록가슴), 복합기형가슴 등에도 사용이 가능하다는 점이 가장 큰 특징이다.
현재 미국에서 경쟁제품으로 꼽히는 짐머바이오메트의 ‘Biomet Pectus Bar’의 경우 제품을 교차해 고정할 수 없고, 일자(一) 모양의 흉벽기형 임플란트 제품 하나만 사용이 가능해 새가슴 및 복합기형가슴에는 사용이 어렵다.
특히, 국내 의료진에 의해 엘앤케이바이오 흉벽기형 임플란트를 사용하는 X 또는 XI 형태의 수술법도 새롭게 개발됐다. 세계 3대 병원으로 꼽히는 미국 클리블랜드 클리닉에서도 해당 수술 기법을 배우고 있어 향후 표준 수술 방법으로 자리잡을 가능성도 높다.
|
이르면 올해 안 품목허가 가능성
엘앤케이바이오는 지난달 말 FDA에 캐슬락-팩투스 품목허가를 신청한 만큼 늦어도 내년 1분기까지는 허가가 나올 것으로 전망된다. 이르면 올해 안에도 허가가 나올 가능성도 크다.
지난달 24일 품목허가 받은 척추 임플란트 ‘블루엑스 시리즈’가 FDA 허가 신청 불과 한달 만에 승인된 바 있어, 캐슬락-팩투스 인허가 시기도 예상보다 빨라질 수 있을 것이란 기대다. 실제로 블루엑스 시리즈의 FDA 인허가 과정을 모두 담당했던 김기향 부회장이 이번 캐슬락-팩투스 인허가도 총괄했다는 점에서 기대감은 더 높아지고 있다.
엘앤케이바이오 관계자는 “일반적으로 FDA 허가는 신청 후 3개월에서 5개월 정도 걸리지만 김 부회장은 인허가 및 품질관리 분야 전문가로 자료 작성 능력 등이 워낙 뛰어나기 때문에 내부적으로는 빠른 허가도 기대하는 중”이라고 설명했다.
엘앤케이바이오 관계자는 “FDA 허가 후 유통은 미국법인 엘앤케이스파인(L&K SPINE)과 이미 유통망을 구축한 이지스스파인이 나눠서 담당할 예정”이라고 말했다.
시장 규모 3조7000억원까지 커질 전망
아직까지 흉벽기형 환자 중 오목가슴 환자만이 수술을 받을 수 있는 상황이었으나 엘앤케이바이오의 흉벽기형 임플란트 출시와 이를 활용한 새로운 수술법이 고안되면서 시장 규모는 빠르게 커질 전망이다.
미국의 오목가슴 수술 관련 흉벽기형 임플란트 시장 규모를 살펴보면 2021년 3727억원, 2022년 4141억원, 2023년 4555억원으로 연평균 성장률(CAGR)은 10.55%에 달한다. 올해는 4992억원까지 성장할 것으로 추정된다.
이는 오목가슴 환자에 한정된 것으로, 향후 새가슴 및 복합기형가슴 환자까지 모두 흉벽기형 임플란트 수술 타깃으로 포함되는 경우 시장 규모는 기하급수적으로 커질 수 있다. 시장조사기관 마켓리서치퓨처(Market Research Future)에 따르면 흉벽기형 임플란트 시장은 2032년 약 3조7000억원(27억달러)까지 성장할 것으로 전망된다.
엘앤케이바이오 관계자는 “미국 전체 인구 중 약 1%가 흉벽기형으로 고통받고 있다”라며 “ XI 수술 기법을 널리 알리고 많은 환자가 수술을 받을 수 있도록 노력하겠다”고 말했다.








![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![[포토]이틀 연속 폭설에 눈 쌓인 북한산](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801096t.jpg)
![[포토]서울리빙디자인페어 in 마곡](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800810t.jpg)
![[포토] 서울역 환승센터](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800768t.jpg)
![[포토] 미국 캘리포니아 '석류' 첫 출시](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800646t.jpg)
![[포토]'돈이 보이는 창' 찾은 함영진 우리은행 부동산리서치랩장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801076t.jpg)
![[포토]통화정책방향 기자간담회, '물 마시는 이창용 한은 총재'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800833t.jpg)
![[포토] '질퍽거리는 눈 피해서'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800590t.jpg)
![[포토]이재명, 한국거래소 찾아 국내 주식시장 활성화 논의](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800462t.jpg)




