크림형 JAK 억제제의 접종연령이 확대될 경우 증세가 경미한 아토피 피부염 환자에게 최적의 대안이 될 수 있다는 평가다. 옵젤루라의 아토피 피부염 적응증에 대한 유럽 내 품목허가도 입박한 것으로 예상되면서 관련 시장이 요동칠 수 있다는 분석이 나온다. 이에 미국 등에서 관련 신약을 개발 중인 JW중외제약(001060)은 “항체나 JAK억제제와 다른 ‘‘퍼스트 인 클래스’로 분명한 수요층이 발생할 것”이라고 자신하고 있다.
|
바르는 JAK ‘옵젤루라’ 매출 2650% 성장
아토피 피부염은 세계 인구의 15~25%가 앓고 있는 흔한 자가면역질환이다. 국가별로 차이는 있지만 소아는 10~20%, 성인은 3% 안팎의 인구가 이 질환을 앓고 있다. 사실상 아토피피부염 치료제로 성공하려면 영유아와 소아에 쓸 수 있는 적응증 획득이 필수인 이유다.
현재 세계 아토피 치료제 시장을 주도하는 프랑스 사노피 ‘듀피젠트’(성분명 두필루맙)는 생후 6개월 이상 중증도에서 중증의 전신 아토피 피부염 환자에서 두루 쓰인다. 이 약물은 지난해 86억8000만 달러(한화 약 11조원)의 매출을 올렸다. 이밖에 비교적 증상이 덜한 환자에서 체내 염증질환을 낮출 항염증제가 경쟁을 펼치는 상황이다.
20일 제약바이오업계에 따르면 아토피 치료제 시장에 새롭게 등장한 것이 JAK억제제다. 미국 화이자 ‘시빈코’(성분명 아브로시티닙)나 애브비의 ‘린버크’(성분명 유파다시티닙) 등 중증 환자를 대상으로 하는 경구용 JAK억제제는 부작용 이슈가 불거지며 다소 주춤하는 모양새다. 이와 달리 바르는 JAK억제제는 증상이 심하지 않은 아토피 피부염 환자의 새로운 치료 대안으로 부상하고 있다.
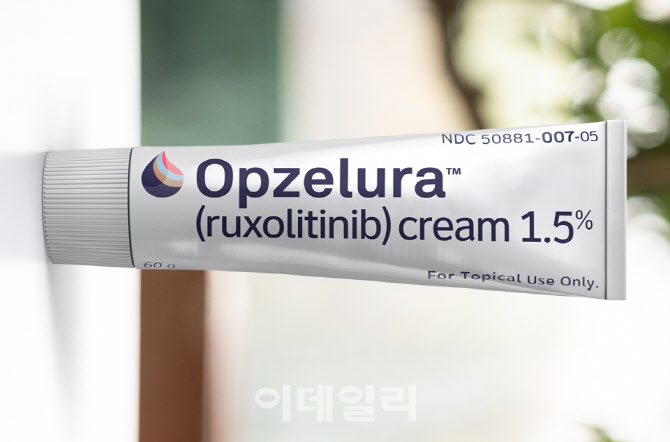
그 중심에 있는 것이 미국 인사이트의 옵젤루라(성분명 룩소리티닙)이다. 이 약물은 2021년 9월 JAK1과 JAK2 동시 억제제로 지난해 미국에서 12세 이상 경증에서 중등도의 아토피 피부염 치료제로 최초 승인됐다. 2022년 옵젤루라 매출은 1억 2873만 달러로 전년(466만 달러) 대비 2657% 급성장했다.
“사용연령 확장 시 옵젤루라 시장 주도약물 가능”
그런데 지난 11일(현지시간) 인사이트는 2세 이상 12세 미만 경증에서 중등도의 아토피 피부염 환자 대상 옵젤루라의 임상 3상에서 1차 평가 지표를 충족한 것이 확인됐다고 했다. 영유아 및 소아 대상 사용 확대 가능성이 크게 높아진 셈이다.
인사이트에 따르면 신체 피부 면적의 3~20%에서 아토피 피부염 증상이 나타난 환자의 상태를 수치화한 ‘연구자 평가 치료 성공’(IGA-TS) 지수는 2~3점이다. 이런 환자에서 옵젤루라를 사용했고, 8주가 지난 시점에서 최소 2점 이상 개선돼 증상이 깨끗하게 치료됐다는 것이다.
짐 리 인사이트 염증 및 자가면역질환 부문 부사장은 “소아 환자에서 요구도가 큰 비스테로이드성 국소 도포제 ‘옵젤루라’는 사용 연령 확대로 인한 잠재력이 매우 클 것”이라며 “규제 기관과 다음단계를 빠르게 논의해 나가겠다”고 말했다. 주사제나 경구제 대비 영유아나 소아환자에서 옵젤루라의 높은 사용 편의성을 강조한 것이다.
아토피 피부염 치료제 유통 업계 한 관계자는 “전신을 대상으로 증세가 심한 환자들에는 듀피젠트같은 주사제가 쓰이겠지만, 증상이 비교적 덜하다면 각종 항염증 기전의 경구약이나 최근 나오는 크림형 제제를 당연히 더 선호할 것”이라고 설명했다.
|
JW중외 “명확한 이중기전 ‘JW1601’, 뉴옵션 될 것”
옵젤루라의 성장성이 강하게 제기되는 상황에서 국내사 중 세계 아토피 피부염 시장을 노리는 후보물질을 보유한 기업으로 JW중외제약이 꼽힌다.
JW중외제약은 지난 2018년 덴마크 레오파마에 기술수출한 ‘JW1601’(해외 프로젝트명 LEO 152020의) 글로벌 임상 2b상이 연내 완료될 것으로 예고하고 있다. JW1601은 히스타민 H4 수용체 억제 기전을 갖고 있다. 18세 이상 경증에서 중증 아토피 피부염 환자 대상 경구 치료제로 미국 등에서 임상되고 있다.
JW중외 관계자는 “코로나 등으로 조금 지연됐지만, 미국 임상사이트에 나온 대로 7월 중 2b상 완료되는 것으로 파악하고 있다, 그 분석시간까지 고려하면 연내 해당 임상이 완료된다”고 설명했다.
일각에서는 JW1601이 3상을 거쳐 최소 3년 뒤 성인 대상 아토피 피부염 치료제로 허가된다고 가정해도 해당 시점에서 옵젤루라가 폭넓은 사용 연령과 접종 편의성으로 시장에서 우위를 차지할 것이란 분석이 나온다.
이에 앞선 관계자는 “JAK 억제제의 시장 확장성을 예의주시해 보고 있다”면서 “그럼에도 우리 약물은 히스타민 H4 수용체로 개발되는 퍼스트 인 클래스 약으로 염증 완화 뿐만아니라 소양증(가려움증)까지 줄이는 확실한 기전을 확인했다. JAK 억제제와 경쟁할 수 있는 효과가 이번 2b상 결과로 확인되길 기대하고 있다”고 운을 뗐다.
그는 이어 “다른 글로벌 제약사를 제치고 JW1601을 레오파마에 기술수출한 것은 그들의 ‘개발완수 의지’였다”며 “레오파마의 소아 적응증 확대전략 등을 직접 언급할 수 없다. 다만 전방위적으로 시장성을 높이기 위한 작업도 진행되고 있다. 우리 약물은 항체나 JAK 억제제의 영역과 다른 신기전으로 수요군을 확대해 나갈 것”이라고 말했다.










![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![강 건너고 짐도 나르고…‘다재다능’ 이상이의 무한변신 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24113000152h.jpg)


![선도지구 탈락 지역, 행정소송 가능할까?[똑똑한 부동산]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24113000125h.jpg)