|
이번 임상 2b상은 듀얼아고니스트를 4mg, 7mg, 10mg 투약하는 시험군과 플라시보군, 비교군으로 구성돼 진행된다. 비교군에는 덴마크 제약사 노보노디스크의 당뇨병 치료제 ‘세마글루타이드(Semaglutide)’ 2.4mg을 투여한다. 세마글루타이드의 다른 이름은 ‘위고비(Wegovy)’로 성인용 비만 치료제다.
머크, 듀얼아고니스트 임상 2b상 개시의 의미는
머크가 듀얼아고니스트의 글로벌 임상 2b상 진입을 준비하고 있다는 것은 해당 신약의 글로벌 임상 2a상 결과가 양호했다는 신호로 해석된다. 듀얼아고니스트의 임상 2a상 중간결과는 오스트리아에서 오는 21~24일(현지시각) 열리는 유럽간학회(EASL)에서 공개될 예정이다. 임상 2b상은 23일에 개시될 예정이므로 학회가 열리는 기간에 바로 후속 임상에 진입하는 셈이다.
임상 2a상 결과 중 주목할 지표는 지방간 감소 수치다. 미국 식품의약국(FDA)에서는 NASH 치료제의 1차 유효성 지표로 섬유화 악화가 없는 지방간 해소, 지방간 악화 없는 섬유화 개선 등 2가지 조건을 제시하고 있다. 일반적으로 2가지 기준 중 1개만 충족해도 NASH 임상이 성공적이라고 평가한다.
바이오업계 관계자는 “NASH 치료제의 경우 유효성을 평가하려면 1년 이상은 살펴봐야 한다”며 “24주 후 지방간 수치 변화만으로 약효가 좋다고 단언하긴 어렵다”고 짚었다. 이어 그는 “아마 머크는 임상 2a상을 통해 해당 약의 추세(trend)와 안전성 정도만 확인하려고 한 것 같다”고 덧붙였다.
따라서 머크는 이번 임상 2b상을 통해 듀얼아고니스트의 유효성을 본격적으로 입증할 것으로 보인다. 해당 임상의 1차 평가지표는 △52주차에 섬유증이 악화되지 않은 참가자의 비율 △60주 내에 부작용을 경험한 참가자의 비율 △52주 내에 부작용으로 약물 투여를 중단한 참가자의 비율 등 3가지다. 2차 평가지표는 △52주차에 지방간이 악화되지 않고 섬유증이 1단계 이상 개선된 참가자의 비율 △52주차에 체중의 기준선(Baseline)으로부터의 변화 등이다.
듀얼아고니스트는 체내 에너지 대사량을 증가시키는 글루카곤, 인슐린 분비, 식욕 억제를 돕는 GLP-1을 동시에 활성화하는 이중 작용 NASH 신약이다. 듀얼아고니스트는 한미약품이 세 번째로 기술 반환 당한 아픈 손가락이었다. 2015년 얀센(J&J)에 9억1500만달러(약 1조600억원)에 당뇨·비만 치료제로 기술수출됐다가 2019년 권리 반환된 듀얼아고니스트는 2020년 머크에 NASH 치료제로 8억7000만달러(약 1조391억원)에 재기술이전되며 기사회생했다.
삼중 작용 NASH 신약 ‘트리플아고니스트’ 기대감도 ↑
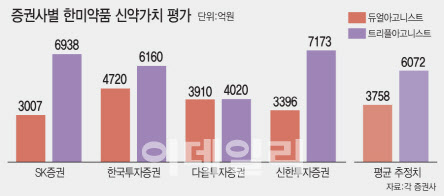
한미약품의 또 다른 NASH 신약 ‘랩스트리플아고니스트(LAPSTriple Agonist)’에 대한 기대감도 상당하다. 4개 증권사는 모두 듀얼아고니스트보다 트리플아고니스트의 신약 가치를 더 높게 평가했다. 트리플아고니스트의 신약 가치는 평균 6073억원으로 추정됐다.
|
트리플아고니스트는 최근 독립적데이터모니터링위원회(IDMC)로부터 임상 지속 권고를 받으면서 글로벌 임상에 대한 불확실성을 해소했다. IDMC는 지난달 트리플아고니스트 임상 2b상에 대해 ‘계획 변경없이 계속 진행하라(continue without modification)’는 권고를 만장일치로 내렸다. 최근 IDMC는 해당 임상에서 평가 중인 3개 용량 중 유효성이 부족한 용량군을 제외하고자 했으나 무용성 기준에 포함되는 용량군이 없다는 결론을 도출했다.
이지수 다올투자증권 연구원은 “(랩스트리플아고니스트 임상 2b상에 대해) 정확한 데이터 확인은 어렵지만 유효성과 안전성이 기대 수준을 충족한 것으로 파악된다”고 말했다.









![[포토]의정갈등에 피해는 환자에게…](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200764t.jpg)
![[포토]사랑의열매, '희망2025나눔캠페인' 시작… 목표액 4497억원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200776t.jpg)
![[포토] 서울 중장년 동행일자리 브랜드 선포](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200708t.jpg)
![[포토]'본회의장 향하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200677t.jpg)
![[포토]표정 어두운 우원식 국회의장, '오늘 예산안 상정 안 해'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200559t.jpg)
![[포토] 화학물질저감 우수제품 발표하는 이병화 환경부 차관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200532t.jpg)
![[포토]교보생명 광화문글판, 유희경 시인 ‘대화’로 새단장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200500t.jpg)
![[포토]우정사업본부, 2025 연하우표 발행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200431t.jpg)
![[포토]비상의원총회, '대화하는 추경호-조정훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200384t.jpg)


![[단독]내년 전세대출에 DSR 적용 안한다…銀 ‘자율규제’로](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120201074b.jpg)
![[속보]미국, 대중국 첨단반도체 수출규제 추가…HBM 포함](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120201250h.jpg)