|
1일 헬릭스미스에 따르면 IDMC는 이날까지 아직 엔젠시스 임상3-2상에 대한 중간권고를 회사에 통보하지 않았다. 엔젠시스는 헬릭스미스가 당뇨병성신경병증(DPN)을 적응증으로 개발 중인 유전자치료제 후보물질이다.
미국 현지에서 어댑티브 디자인 방식으로 진행 중인 엔젠시스 임상3-2상에 대해 IDMC는 목표 임상 대상자의 절반에 투약이 이뤄진 후 중간평가를 한다. IDMC는 △임상시험 대상자 수 변동없이 진행 △임상시험 대상자 수 조정 후 진행 △임상시험 대상자 등록 중단의 세 가지 시나리오 중 하나를 권고하는 것이다. 이중 임상시험 대상자 등록 중단 권고는 투자판단에 민감한 영향을 줄 수 있는 사항으로 해당 권고를 받게 되면 회사는 관련 내용을 즉시 공시해야 한다.
헬릭스미스 관계자는 “엔젠시스 DPN 임상3-2상이 당사 주가에 큰 영향을 미치기 때문에 거래소 측에서는 임상 중단 권고뿐 아니라 어떤 내용의 레터를 받든 관련내용을 공시할 것을 회사에 권고했다”며 “1일 오후 5시 기준 IDMC측으로부터 어떤 공식 답변도 받지 못했다”고 말했다.
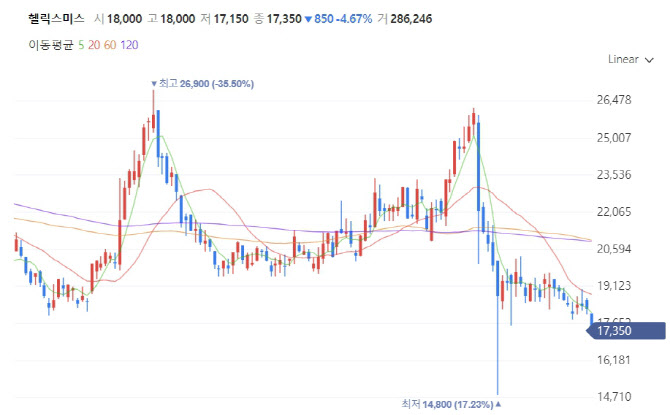
회사측은 7월께 IDMC가 권고를 내릴 것으로 예상했다. 한국시간으로 지난 6월17일 미국 샌디에이고에서 열린 ‘바이오 인터내셔널 컨벤션’(바이오USA)에 참석한 김선영 헬릭스미스 대표이사는 기자들과 만나 “7월 중순 엔젠시스 3-2상 중간결과가 나올 것”이라고 언급한 바 있다. 맥락상 이 ‘중간결과’는 IDMC의 권고에 해당하는 것으로 해석된다. 해당 발언이 국내 언론에 보도된 직후 제자리걸음하던 주가는 같은 달 27일까지 7일간 약 18%가량 급등했다.
|
회사측은 “7월 중순 엔젠시스 DPN 임상3-2상에 대한 IDMC의 중간권고가 발표될 것으로 예상한다는 내용을 인터뷰나 간담회를 통해 말했지만 이는 업계 일반적인 현황과 사례를 토대로 예측한 것일 뿐 회사가 원하는 시점에 권고를 받는 것은 어렵다”며 “DPN 임상 진행에 대해서는 전자공시를 통해 정확한 소식을 전달할 것”이라고 강조했다.
중간권고 일정이 늦춰졌지만 회사측에서는 긍정적인 전망을 내려놓지 않은 상태다. 김 대표는 지난 6월28일 기자간담회에서 “IDMC가 내놓을 중간권고 결과에 따라 엔젠시스 DPN 임상3-2상 관련 상황이 달라질 수는 있지만 우리 기대를 크게 벗어나지는 않을 것”이라고 자신했다.
이번에 IDMC로부터 중간권고가 이뤄지더라도 이것은 엔젠시스 DPN 임상3-2상에 대한 중간결과 발표는 아니다. 김 대표는 “IDMC가 DPN 임상3-2상을 기존 설계대로 진행하라고 할 경우 탑라인 결과는 내년 1분기 중 발표될 것으로 예상된다”고 언급했다.










![[포토]수험표 확인하는 수험생](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111301259t.jpg)
![[포토]'악수하는 주호영-추경호'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111301245t.jpg)
![[포토]태광그룹 노동조합협의회, '김기유 구속하라'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111301220t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111301017t.jpg)
![[포토]로제, 전세계 '아파트' 열풍으로 물들이고 입국](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111201326t.jpg)
![[포토]간호법 제정 축하 기념대회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111200857t.jpg)
![[포토]수능 안내문 살펴보는 일성여중고 수능 최고령 응시자 임태수씨](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111200809t.jpg)
![[포토]변화하는 안보환경과 해군의 미래전 대응, '축사하는 이기정 총장'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111200781t.jpg)
![[포토] 포장김치 구입](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111200687t.jpg)

![[포토]'이보미 골프 갤러리'오픈](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111100375h.jpg)


![[단독] 김나정, 필리핀 대사관에도 "마약 했다" 도움 요청](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111301049h.jpg)