|
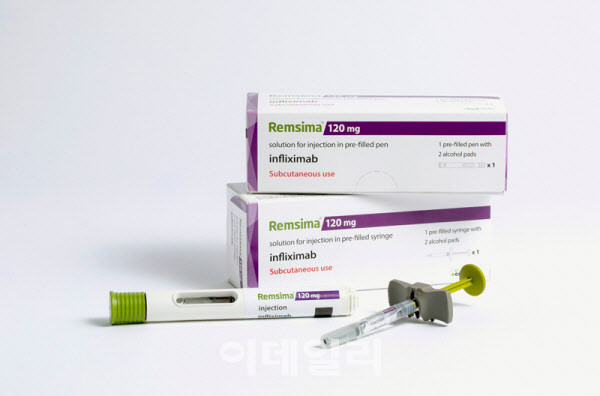
23일 스웨덴 스톡홀름매산(Stockholmsmassan) 컨벤션 센터에서 열린 유럽 크론병 및 대장염학회(ECCO 2024) 현장에서 만난 셀트리온 관계자에 따르면 램시마SC 글로벌 임상 3상이 마무리됐음에도 일본 사이트 환자들의 램시마SC 추가 처방 요구가 이어졌던 것으로 확인됐다.
셀트리온 관계자는 “궤양성대장염(UC)과 크론병(CD) 환자들을 대상으로 램시마SC 2년 글로벌 장기 임상 3상을 진행해왔다”며 “글로벌 임상이다 보니 일본 사이트에서도 환자들을 대상으로 임상을 진행했는데, 임상이 종료된 후 일본 환자들은 램시마SC 처방을 계속 받고 싶다며, 임상 확대 요청 등 처방 방법 문의가 쇄도했다”고 말했다.
이런 현상은 현재 일본 시장에 램시마SC가 허가를 받지 않아 아직 진출 전이라는 점을 고려하면 이례적이라는 설명이다. 결국 램시마SC가 뛰어난 효능을 보이고, 그 효능이 장기적으로 지속되는 것을 몸소 체험한 임상 환자들이 스스로 램시마SC 처방을 원하는 것으로 풀이된다.
특히 자녀가 있는 젊은 여성 크론병 환자가 인플릭시맙 IV를 처방받다가 램시마SC로 스위칭해 삶이 개선돼 매우 기뻐했고, 자신이 램시마SC를 처방해 환자 삶이 변화하는 것을 직접 지켜본 의사가 감동의 눈물을 흘렸던 사례는 프랑스 내에서 유명한 일화로 알려졌다. 램시마SC의 거센 열풍으로 프랑스 대표 일간지 르몽드에 셀트리온과 램시마SC에 대한 자세한 소개 기사가 실리기도 했다.
동유럽 국가인 체코에서는 의료진이 램시마SC를 환자에게 적극적으로 사용하고 있는 것으로 나타났다. 이날 이데일리와 만난 밀란 루카스 체코 카를로바 대학교 교수는 “진료하고 있는 환자 중 인플릭시맙 IV에서 램시마SC로 스위칭한 환자 중 약 60~70%가 아주 만족해하고 있다”며 “우리 센터에는 약 1만1000명의 염증성 장질환 환자들이 있는데, 램시마SC 처방률은 70%에 달한다”고 말했다.
|
편의성·최신 치료법 증명·장기 유효성...신약 이미지 구축
점막 치유와 내시경적 치유는 최근 미국 식품의약국(FDA)과 유럽 의약품청(EMA)에서 염증성 장질환 임상시험 1차 평가 변수로 권고하는 등 IBD 분야 최신 치료 트렌드로 주목받고 있다. 또 인플릭시맙 유일 SC 제형인 램시마SC는 단순 IV 제형에서 SC 제형으로 변경한 의약품이 아닌 하나의 독립적인 의약품, 더 너아가 신약으로의 개념이 더 어울린다는 평가를 받았다.
밀란 루카스 교수는 개인적인 의견임을 강조하면서도 “유럽과 미국은 상황이 다르긴 하지만 램시마SC를 바이오베터보다는 신약 전략이 더 효과적이고 좋은 접근 방식이라는 것에 동의한다”며 “아무래도 인플릭시맙이라는 제제는 같지만, 다른 제형으로 이뤄진 것이고, 현재 승인된 것은 아니지만 류머티즘 치료에서 사용되고 있는 만큼 이런 부분에서 허가를 받게 되면 좀 더 신약으로 강조할 수 있을 것”이라고 언급했다.
|










![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)

![40년간 아무도 예상치 못한 AI 붐에 대비한 '이 사람'[파워人스토리]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122300015b.jpg)

