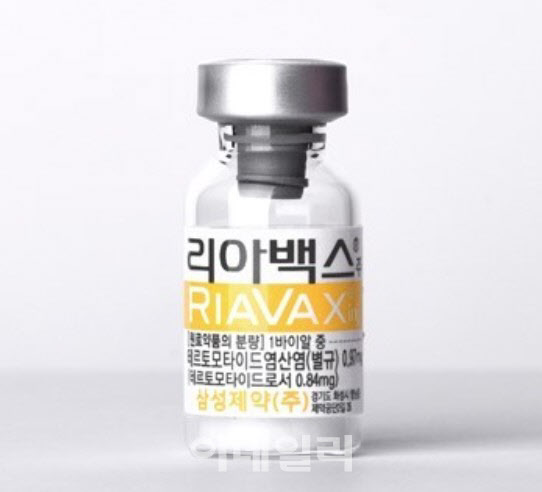
2일 제약바이오 업계에 따르면 젬백스앤카엘의 리아백스 허가 재신청이 2년 넘게 지연되고 있다. 리아백스는 젬백스앤카엘이 췌장암치료제로 개발해 2014년 9월 15일 국산 신약 21호로 조건부 허가를 받았다. 임상 3상 승인일인 2015년 3월 13일로부터 5년 후인 2020년 3월 13일까지 3상 결과보고서를 식품의약품안전처에 제출하는 조건이었다. 하지만 회사는 3상 결과보고서를 기한 내 제출하지 못했고, 2020년 조건부 허가가 취소됐다.
이후 회사는 2020년 12월 임상 3상 결과보고서를 수령하고, 2021년 6월 미국임상종양학회(ASCO)에서 발표했다. 해당 임상은 2015년 11월부터 2020년 4월까지 총 148명의 췌장암 환자를 대상으로, 이오탁신 고농도 환자에게 젬시타빈과 카페시타빈, 리아백스(GV1001)를 함께 투여하는 방식으로 진행됐다.
1차 평가지표는 전체 생존율(OS)이었다. 회사 측 발표에 따르면 리아백스 투약군이 11.3개월, 대조군이 7.5개월로 통계적 유의성(p=0.021)을 보였다. 이 결과를 바탕으로 2021년 내 리아백스 정식 허가를 신청하겠다고 했다. 하지만, 2년째 허가 신청 소식은 들리지 않고 있다. 젬백스앤카엘은 2015년 리아백스 국내 실시권을 약 50억원 규모에 자회사인 삼성제약에 기술이전 한 바 있다.
|
하지만 신약 품목허가를 신청하는 데 있어 논문 및 게재 여부는 중요한 것이 아니라는 지적이 있어왔다. 실제로 식약처 관계자는 “신약 품목허가 규정에 논문 게재를 필수로 정하고 있는 것은 없다”며 “다만 허가 신청 시 임상시험 성적에 관한 자료(외국자료의 경우)는 허가국 정부가 제출받았거나 승인했음을 확인해 공증한 자료, 과학논문인용색인(SCI)에 등재된 전문학회지에 게재된 자료를 제출할 수 있다”고 말했다. 즉 허가 신청을 위해 논문을 투고하지 않거나 게재하지 않아도 아무런 영향이 없다는 설명이다.
업계 한 관계자는 “계속 논문 게재를 전제하는 것은 임상 3상 결과를 인정받기 위한 것으로 보인다”며 “자신이 있다면 식약처가 허가한 대로 임상 3상을 진행해서 CSR이 나왔고, 제조도 정해진 방법이 있기 때문에 적격심사를 받으면 되는 것”이라고 지적했다.
리아백스 허가 전략 변경, 선회 배경은
특히 리아백스 허가 신청과 관련된 준비는 계속 진행 중이었기 때문에 신속한 진행이 가능할 것이라고 설명했다. 회사 관계자는 “리아백스 허가 신청 준비는 논문과는 별개로 계속 준비해 왔다”면서 “준비를 해 온 만큼 최대한 빨리 허가 신청을 진행해 보겠다는 게 회사 입장”이라고 말했다.
업계는 회사 측의 이같은 허가 전략 변경과 관련 복합적인 요소들이 영향을 끼쳤을 것이라고 보고 있다. 업계 한 관계자는 “삼성제약이 리아백스 허가 전략을 수정한 것은 대내외적인 영향이 있었을 것”이라며 “당초 2021년 허가 신청이 예상됐지만, 논문 게재 등을 이유로 미뤄졌다. 이에 대한 투자자들의 불만도 고조돼 있었고, 회사 측에서도 허가에 대한 의지를 확인시켜주는 제스처가 필요했던 것으로 보인다”고 분석했다.
또한 삼성제약은 10년째 실적악화가 이어지고 있어 리아백스를 통한 반등이 필요한 상황이다. 최근 5년만 하더라도 △2018년 매출 465억원, 영업적자 48억원 △2019년 매출 446억원, 영업적자 65억원 △2020년 매출 483억원, 영업적자 100억원 △2021년 매출 548억원, 영업적자 181억원 △2022년 매출 518억원, 영업적자 140억원으로 실적악화가 지속되는 상황이다. 캐시카우가 될 수 있는 리아백스 허가에 속도를 내야 하는 이유다.








![[포토]원내대책회의 참석하는 박찬대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111200338t.jpg)
![[포토]환율은 오르고 코스피-코스닥 하락](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111101008t.jpg)
![[포토]'이보미 골프 갤러리'오픈](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100375t.jpg)
![[포토]2025학년도 수능 3일 앞으로](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100917t.jpg)
![[포토]미국 대선 영향, 비트코인 8만1000달러 돌파](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100878t.jpg)
![[포토] 29회 농업인의날](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100842t.jpg)
![[포토]김장나눔 펼치는 함영주 회장과 하나금융그룹 임직원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100765t.jpg)
![[포토]'발언하는 손경식 회장'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100640t.jpg)
![[포토]최고위, '모두발언하는 박찬대 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100624t.jpg)
![[포토]마다솜,통산 4승 만들어준 넘버원 볼](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100280t.jpg)

![[포토]'이보미 골프 갤러리'오픈](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111100375h.jpg)


