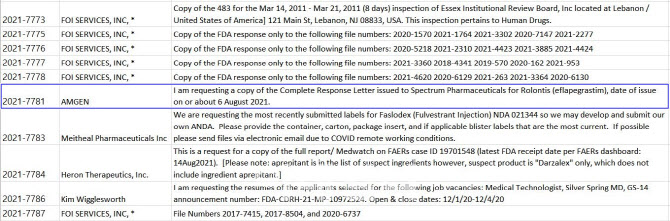
21일 제약바이오 업계에 따르면 암젠은 FDA 품목허가 절차를 밟고 있는 한미약품(128940) 신약 롤론티스 허가 관련 서류를 요청했다. 실제로 암젠은 FDA가 지난해 8월 6일 한미약품 파트너사인 스펙트럼에게 롤론티스 생물학적제제 허가신청서(BLA)에 대해 보낸 최종보완요구공문(CRL) 사본을 요청했다.
지난해 3월 국산 33호 신약으로 허가받은 롤론티스는 한미약품이 2012년 미국 스펙트럼에 기술수출(2380만 달러)한 호중구감소증 치료 신약이다. 한미약품의 독자 플랫폼 기술인 ‘랩스커버리’가 적용된 바이오의약품이다. 항암화학요법을 받는 암 환자에서 발생하는 호중구감소증의 치료 또는 예방 용도로 투여된다. 호중구감소증은 백혈구 일종인 호중구 수치가 비정상적으로 감소해 세균이나 바이러스에 의한 감염에 취약해지는 혈액병이다.
지난해부터 미국 품목허가를 진행 중이다. FDA는 한미약품 평택 바이오플랜트를 실사 후 지난해 8월 6일 스펙트럼에 롤론티스 생산 관련 자료 보완과 제조시설 재실사를 요구하는 CRL을 보냈다. 한미약품은 지난 4일 스펙트럼에 240억원 규모 전략적 투자를 단행했다.
|
호중구감소증 치료제 시장은 연평균 5.6% 성장해 2025년 126억 달러에 달할 것으로 전망되는 거대한 시장이다. 해당 시장 톱티어는 바로 암젠이 개발한 뉴라스타다. 연 매출이 약 50억 달러에 달하는 블록버스터 제품이다. 다만 가격 경쟁력을 갖춘 바이오시밀러 제품들이 출시되면서 매출은 하락세다.
암젠의 롤론티스 CRL 정보 공개요청도 이와 무관하지 않다는 게 업계의 대체적인 시각이다. 실제로 FDA에서 오랜 기간 근무했던 전문가들도 타 기업의 허가 실사 자료를 요청하는 것은 극히 이례적이라고 입을 모은다. FDA 심사관 출신의 한 업계 관계자는 “암젠의 이런 요구는 일반적이진 않다. 상업화를 더 늦추기 위한 전략으로 풀이된다”며 “롤론티스가 개량신약 성격의 바이오베터이기 때문에 생산기술 관련 경쟁사 정보를 찾아본 것으로 판단된다”고 말했다.
뉴라스타 뛰어넘는 롤론티스, 경쟁은 불가피
롤론티스 임상 3상 결과에 따르면 뉴라스타 대비 비열등성을 보였다 특히 약효 지속성 면에서 뉴라스타를 앞선 것으로 알려졌다. 한미약품 관계자는 “임상 3상 결과 동일 용량에서 롤론티스가 뉴라스타 대비 약효 지속기간이 2주 정도 길다”면서 “국내에서 약효 지속성을 마케팅 포인트로 잡아 세일즈를 하고 있다”고 말했다.
한미약품과 스펙트럼은 올해 안으로 롤론티스 미국 승인을 기대하고 있다. 다만 업계는 롤론티스도 뉴라스타와 마찬가지로 바이오시밀러 제품들과의 치열한 경쟁이 불가피할 것으로 보고 있다. 업계 관계자는 “뉴라스타는 2018년 바이오시밀러 풀필라(바이오콘) 출시를 시작으로 니베프리아(화이자), 지엑스텐저(노바티스) 등과 경쟁하고 있다. 뉴라스타 평균 약가는 2년 동안 약 1000달러가 하락했다”며 “롤론티스도 가격 경쟁력을 갖춰야 승산이 있을 것으로 본다”고 강조했다.









![[포토] 평창고랭지 김장축제](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501303t.jpg)
![[포토] 종로학원, 대입 합격점수 예측 설명회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501114t.jpg)
![[포토]이재명 민주당 대표 '징역 1년에 집행유예 2년'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501110t.jpg)
![[포토]'구속VS무죄' 이재명 공판 앞두고 쪼개진 서초동](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111500881t.jpg)
![[포토] 개인정보보호위원회 기자설명회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111500752t.jpg)

![[포토]고생했어~](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401524t.jpg)
![[포토] 걷고 싶은 거리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401206t.jpg)
![[포토] 광복 80주년 기념사업 시민위원회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401169t.jpg)
![[포토]1400원 뚫은 원-달러 환율…외환당국 '적극개입' 시그널](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401121t.jpg)

![[이車어때]"8800만원짜리 드림카"…벤츠 AMG A 45 S 4MATIC+](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600211h.jpg)
![“일 멈추고 멍 때리세요”…매일 ‘멍시’ 주는 이 회사[복지좋소]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600042b.jpg)

![“돈은 나가는데 해지는 어렵고”…카드 부가상품 해지 어쩌나[카드팁]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600184h.jpg)