|
28일 현재 녹십자는 고대안산병원·경북대병원·계명대 동산병원·대구파티마병원 등 4곳을 통해 코로나19 완치자 539명의 혈장 공여 신청을 받았다. 이 중 292명에 대해서는 채혈까지 완료했다.
녹십자 집계엔 대구·경북지역 신천지예수교회 관련 혈장 기증 및 공여자 인원이 빠져있는데, 신천지예수교회에 따르면 지난 27일 기준 혈장 기증 의사를 밝힌 신천지성도는 4200여명에 달한다. 13일부터 17일까지 닷새간 409명은 단체로 혈장 공여를 마쳤다. 이후로도 30명이 추가로 혈장을 제공했다.
신천지예수교회를 통한 혈장 공급 분을 합치면 혈장 공여 신청자는 4740명을 넘어섰으며 총 731명의 혈장을 확보했다.
|
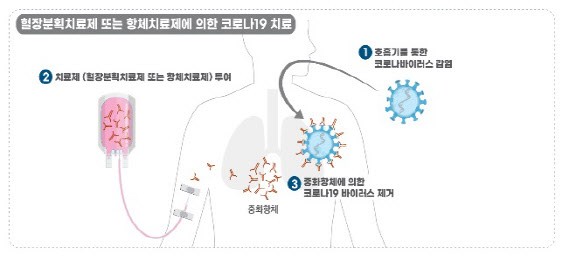
이미 녹십자는 지난 18일 충북 청주시 오창공장에서 코로나19 혈장 치료제 ‘GC5131A’의 임상시험용 제품 생산을 개시했다. 혈장 분획 공정 중으로 인체 임상 준비를 본격화했다. 녹십자 국내 혈액제제 생산시설인 오창공장은 연간 140만ℓ 규모의 혈장을 처리할 수 있다. 특히 선제적으로 2배 증설한 오창공장 가동률을 높이는 것으로 전해졌다.
식약처는 코로나19 치료제·예방 백신 개발 속도를 높이고자 올해 4월 13일부터 ‘고강도 신속 제품화 촉진 프로그램’(고(GO)·신속 프로그램) 본격 운영에 들어간 상태다. 통상 30일가량 소요되는 임상시험 심사 기간을 대폭 줄여 신물질의 경우 ‘15일 이내’로 심사 시일을 절반 단축한다는 입장이다. 따라서 다음 달 중순께 2상 시험에 착수할 전망이다. 녹십자는 임상 1상을 면제받고 곧바로 2상으로 직행하는 것으로 알려졌다.
|
지금까지 셀트리온(068270)이 질본과 국책과제로 개발 중인 ‘항체’ 치료제 ‘CT-P59’를 포함해 11개 치료제가 임상 단계에 진입했다. 부광약품(003000)이 지난 4월 국내 제약사 가운데 가장 먼저 2상을 신청했다. 부광약품은 자사의 B형 간염 치료제인 ‘레보비르’(성분명 클레부딘)를 약물 재창출 방식에 따라 코로나19 항바이러스 치료제로 개발 중이다. 환자 60명을 대상으로 고대구로병원과 고대안산병원 등 전국 8개 병원에서 실시하고 있다. 부광약품은 임상 2상 시험을 오는 10월까지 마무리할 예정이다.
녹십자 관계자는 “이번 주 임상 계획을 신청할 계획”이라며 “임상적 투여 외에도 ‘치료 목적 사용’ 등 다양한 경로로 의료 현장에서 치료제가 사용될 것”이라고 내다봤다.









![[포토]내수경기활성화 민당정협의회 열려](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700609t.jpg)
![[포토]입장하는 이재명 대표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700546t.jpg)
![[포토] 달려라~](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700515t.jpg)
![[포토]이재명 "한덕수·국민의힘 내란 비호세력 탄핵 방해로 민생 경제 추락"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700363t.jpg)
![[포토] 광화문광장 나눔온도 70.5도](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600729t.jpg)
![[포토]조중석 이스타항공 대표-고토다 도쿠시마현지사 인사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600693t.jpg)
![[포토]여야 합의 강조하는 한덕수](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600665t.jpg)
![[포토]김용현 전 국방부 장관 변호인단 기자회견 열어](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600563t.jpg)
![[포토]윤이나,밝은 모습 인터뷰 시간](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600087t.jpg)

![[포토]윤이나,후배 양성을 위해 2억원 기부했어요](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122600088h.jpg)

![1480원 뚫고도 힘 안 떨어졌다…"환율 상단 논하기 힘들어"[외환분석]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122700563h.jpg)
