|
12일 법조계 및 제약·바이오업계에 따르면 서울행정법원 행정12부(홍순욱 부장판사)는 이날까지 1차례 연장한 인보사 품목허가 취소처분건의 ‘잠정 효력정지’ 기간을 추가로 연장하지 않았다.
서울행정법원 관계자는 “재판부가 한 차례 잠정 효력정기 기간을 연장한 것 외에 추가로 연장 한 게 없다”고 말했다. 식약처 및 코오롱생명과학측 모두 재판부의 추가 심리기일 필요에 대해 통보받은 바 없다고 밝혔다.
앞서 서울행정법원은 지난달 23일 열린 심문기일에서 같은달 29일로 지정했던 종국 결정 전 잠정 효력정기 기간을 이달 14일까지로 연장한 바 있다.
양측은 법원 판단을 숨죽이며 기다리고 있지만 코오롱생명과학은 품목허가 취소를 즉각 정지해야한다고 주장하는 반면 식약처는 당장 집행돼야 한다는 입장을 강력히 나타내고 있다.
코오롱측 관계자는 “효력정지 사안은 취소처분이 정지되지 않을 경우 회사의 회복하지 못할 손해를 예방할 필요성이 있는지가 핵심 판단 사항”이라며 “당장 처분 효력이 발생하면 인보사는 의약품으로 시장에서 퇴출되고 기업은 존립 자체가 위태로워질 것”이라고 역설했다.
식약처는 품목허가를 받았을 때와 성분이 달라져 사회적으로 논란이 큰 사안인 만큼 즉각 품목허가를 취소해야 한다는 입장이다. 식약처측은 “집행정지를 인용할 경우 법원이 인보사 안전성 등에 대해 다른 신호를 줄 수 있다”고 우려하고 있다.
한편, 서울행정법원 제14부(부장판사 김정중)식약처의 또다른 처분인 경증 환자를 대상으로 한 인보사 임상시험 계획 취소 처분건의 집행정지에 대해 잠정 효력정지를 시키지 않은 채 지난달 26일 “3~4주 뒤에 결정하겠다”고만 밝혔다..
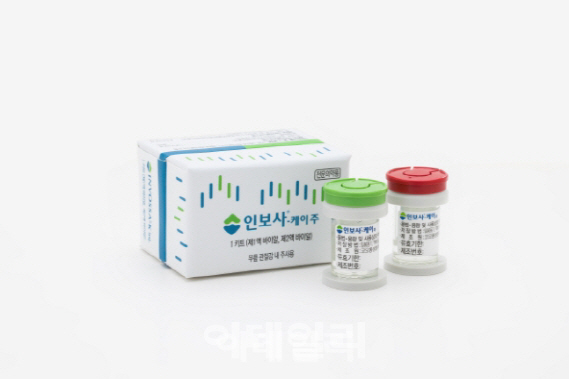
인보사는 2017년 7월 국내 최초의 유전자 골관절염 치료제로 식약처 허가를 받았다. 하지만 지난 3월 치료제 주성분 중 하나가 허가사항에 기재된 연골세포가 아닌 종양 유발 위험이 있는 신장세포라는 사실이 드러나 취소됐다.








![[포토]2024 크리스마스 씰 증정식](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800960t.jpg)
![[포토]11만 달러 바라보는 비트코인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800947t.jpg)
![[포토] '복합지원 2.0' 우수 직원 표창](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800923t.jpg)
![[포토]우원식 국회의장, '군 장병들과 오찬'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800878t.jpg)
![[포토]한지은, 화려한 등장](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800102t.jpg)
![[포토]'발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800811t.jpg)
![[포토]서울광장 스케이트장 요금 올해도 “1000원”](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800734t.jpg)
![[포토] 대왕고래 시추 준비](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800720t.jpg)
![[포토] 농기계 정비 시연하는 강호동 농협 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800639t.jpg)
![[포토]본격 겨울추위 보내야하는 쪽방촌](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121800589t.jpg)
![가볍고 경쾌한 속도감…'MINI 쿠퍼 C 3-도어'만의 매력[타봤어요]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900052h.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


