|
알테오젠·삼천당제약 임상 순항
12일 제약 바이오업계에 따르면, 지난해 1조6000억원의 규모의 바이오의약품 제형 변경 효소 및 관련 기술을 수출한 알테오젠(196170)이 황반변성 치료제 아일리아의 바이오시밀러(ALT-L9)에 대한 국내 임상 1상에 나서 첫 환자 투여를 개시했다. 아일리아는 글로벌제약사 바이엘의 오리지널 황반변성 치료제로 지난해 글로벌 매출 8조원을 거둔 블록버스터 신약이다. 알테오젠은 글로벌 임상 3상 준비에도 착수한 상태다.
삼천당제약(000250) 역시 이달 초 아일리아 바이오시밀러(SCD411)에 대한 비임상시험(동물시험)을 마치고 글로벌 3상에 돌입했다. 바이오시밀러는 통상 일반적인 의약품이 임상 1·2·3단계를 거치는 것과 달리 임상 2상을 건너뛴다. 이미 있는 의약품을 복제해서 만들기 때문이다. 또한 안과 질환 치료제 특성상 눈에 약을 투여해야 하기에 허가당국과 협의하에 건강한 사람을 대상으로 약의 부작용을 주로 보는 임상1상을 하지 않고 대규모 환자 대상으로 약의 효능을 주로 보는 임상3상을 바로 하기도 한다.
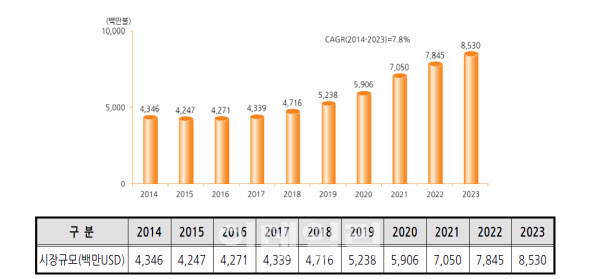
한국보건산업진흥원에 따르면 미국 및 프랑스, 독일, 이탈리아, 스페인, 영국 등 유럽 5개국의 노인성 황반변성(습성) 유병인구는 2015년 251만명에서 2035년 387만명으로 늘어날 전망이다. 황반변성은 습성과 건성이 있는데 심각한 시력상실을 유발하는 쪽은 습성으로 90% 정도를 차지하고 있다. 관련 환자수가 늘면서 노인성 황반변성(습성) 치료제 글로벌 시장규모 역시 2014년 기준 43억달러(5조원)에서 2023년 85억달러(10조원)규모로 확대될 전망이다. 국내 역시 황반변성 건강보험 진료인원이 2014년 10만1700명에서 지난해 17만7400명으로 74% 늘어났다.
완치 방법 無...치료제 적고 고가… ‘시밀러’ 주목
이런 점을 감안해 일찍 황반변성 치료제 개발에 뛰어든 삼성바이오에피스는 치료제 개발을 눈앞에 두고 있다. 루센티스의 바이오시밀러인 ‘SB11’의 경우 지난해 12월 임상을 완료하고 연내 유럽과 미국 판매허가를 신청할 예정이다. 아일리아 바이오시밀러인 ‘SB15’는 현재 전임상 단계로 연내 글로벌 임상 3상에 착수할 예정이다. 전통 제약사 가운데서는 종근당이 루센티스 바이오시밀러 ‘CKD-701’에 대해 국내 임상 3상을 진행중이다.
업계 관계자는 “바이오시밀러의 특성상 시장에 먼저 진입하는 퍼스트 무버(선도자)가 이점을 톡톡히 누리기 때문에 시장 선점 경쟁이 더 치열해지고 있다”며 “안과질환 치료제는 신약 개발도 어렵고 시장은 계속 커지고 있다”고 말했다.








![[포토] '금융권 공감의 장' 인사말하는 이병래 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600936t.jpg)
![[포토]경북 국립의대 신설 촉구, '참석자들에게 인사하는 한동훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600846t.jpg)
![[포토]손태승 전 회장, 영장실질심사 출석](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600794t.jpg)
![[포토]정윤하 등장](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600056t.jpg)
![[포토]내년에 또보자 가을](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600715t.jpg)
![[포토]민주당 민생연석회의 참석하는 이재명 대표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600655t.jpg)
![[포토] '소상공인 힘보탬 프로젝트' 발표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600583t.jpg)
![[포토]정부, 국무회의에서 세번째 `김여사 특검법` 거부권 건의 의결](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600579t.jpg)
![[포토] 이즈나 데뷔](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500181t.jpg)
![[포토]첫 싱글 '라스트 벨'로 돌아온 TWS](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500118t.jpg)




![[속보]트럼프 관세 엄포에도…다우·S&P500 사상 최고치](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112700117h.jpg)