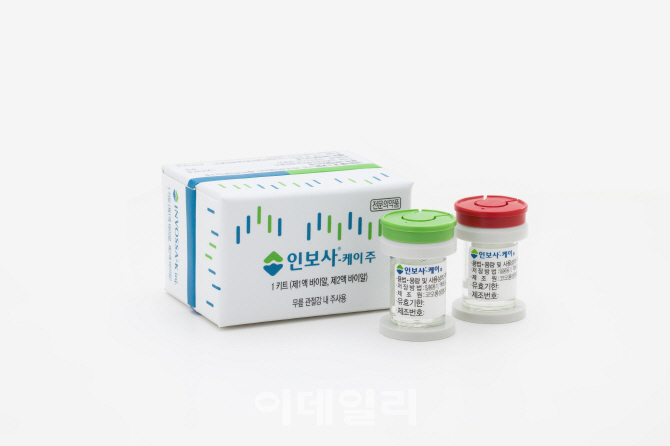
[이데일리 강경훈 기자] 세포가 뒤바뀐 것으로 밝혀진 세계최초 퇴행성관절염 유전자치료제 ‘인보사’(사진)와 관련해 전문가들이 안전성 우려를 나타내고 있다. 회사 측이 주장하는 초기 개발부터 상용화까지 인보사의 성분이 바뀌지 않은 만큼 안전하다는 입장과 대비되는 상황이라 관리당국인 식품의약품안전처의 최종 판단에 관심이 쏠린다.
대한류마티스학회는 최근 ‘골관절염 세포치료제의 개발 현황과 개선방향’을 주제로 토론회를 개최했다. 이날 토론회에서 주지현 서울성모병원 류마티스내과 교수는 “연골유래세포를 만드는 데 쓴 신장유래 293세포는 특정 단백질이나 유전자를 보유한 바이러스를 생산해 연구용으로 많이 쓴다”며 “이를 이용해 치료제를 만드는 것은 식약처나 미국 식품의약국(FDA)가 허용하지만 이 세포 자체는 아직 치료제로 허가받지 못했다”고 말했다.
이 신장유래세포에 성장인자(TGF-β1)가 발현된 레트로바이러스를 증식시킨 후 세포 배양액에서 레트로바이러스만 분리하는 과정을 거친다. 코오롱생명과학은 이 과정에서 신장유래세포가 제대로 분리되지 않고 일부가 포함된 것으로 추측하고 있다. 이에 대해 이상일 경상대병원 교수는 “탈분화로 세포 성격이 바뀌고 정상적인 연골세포의 증식이 어렵다는 것을 고려하면 신장세포와 형질전환 연골세포의 규명이 초기부터 필요했다”며 “이는 염색체 핵형분석을 통해 염색체 숫자를 확인하면 쉽게 알 수 있었을 것”이라고 말했다. 회사 측은 형질전환세포의 종양원성(무한정 증식하는 특성)을 없애기 위해 방사선 조사를 거쳐 세포로서의 기능을 상실시켰기 때문에 안전하다고 주장한다. 이 과정은 FDA가 형질전환세포를 만들 때 권고하는 처치법이다.
이 신장유래 형질전환세포가 미국 허가의 키를 쥐고 있다는 의견도 있다. 원칙적으로는 신장유래세포 자체를 치료제로 쓸 수 없는 상황에서 인보사에 신장유래세포가 든 것이 확인됐기 때문이다. 한 업계 관계자는 “신장유래세포가 들어간 것이 확인된 만큼 어느 단계에서 어떤 이유로 섞였는지 밝혀내지 못하면 허가를 유지할 수 없을 것”이라고 말했다.
한편 식약처는 인보사 원 개발사인 코오롱티슈진 미국 본사에 대한 현지실사를 계획하고 있다. 코오롱티슈진이 미국 회사이고 식약처가 미국 회사에 대한 강제 조사권이 없어 조사가 어려울 수 있다는 지적이 있다. 이에 대해 코오롱생명과학 관계자는 “코오롱생명과학 대표가 코오롱티슈진의 대표를 겸하고 있는 상황이라 현지 조사가 어려울 수 있다는 예상은 어불성설”이라며 “식약처의 조사에 적극적으로 협조해 세간의 의혹을 명확하게 해소할 것”이라고 말했다.









![[포토] 훈련장 이동하는 '시니어 아미'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110401152t.jpg)
![[포토] 오세훈 시장과 김병주 MBK 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400960t.jpg)
![[포토]코스피-코스닥 동반상승](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400947t.jpg)
![[포토]SK AI 서밋 부스 살펴보는 이재명 대표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400862t.jpg)
![[포토]수능 D-10](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400794t.jpg)
![[포토] '한국 자본시장 컨퍼런스' 세레모니](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400583t.jpg)
![[포토] 한국 자본시장 컨퍼런스 참석한 김병환 위원장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400529t.jpg)
![[포토]검찰, 류광진 티몬 대표 소환 조사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400519t.jpg)
![[포토] 이동민 '우승트로피 번쩍 들고'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110300177t.jpg)
![[포토]'덕수궁의 가을'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110300295t.jpg)

![[포토]마다솜,빛나는 트로피와 금메달](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400342t.jpg)
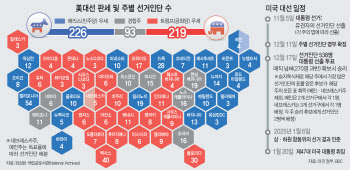
![[속보]대선 하루 앞두고…뉴욕증시 일제히 하락](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110500103b.jpg)
