서울대병원 혈액종양내과 고영일·변자민 교수, 서울대 생명과학부 윤태영 교수(전창주 연구원), 프로티나 공동 연구팀이 단분자 공면역침강(SMPC) 기술을 통해 BCL2 단백질과 다른 단백질들 간의 상호작용을 분석하여, ABT-199 표적 항암제의 치료 효과를 예측할 수 있는 고성능 동반진단 바이오마커를 개발했다고 6일 발표했다.
급성 골수성 백혈병(AML)은 혈액 또는 골수 내 비정상 백혈구가 급격히 증식하여 정상 혈액 세포의 생성을 방해하는 혈액암의 일종으로, 신속하고 효과적인 치료법의 선택이 매우 중요하다. BH3 모사체는 BCL2 단백질을 표적으로 하여 암세포의 사멸을 유도하는 약물로, 특히 ‘ABT-199(Venetoclax)’ 표적 항암제는 AML 치료에 높은 성과를 보였다.
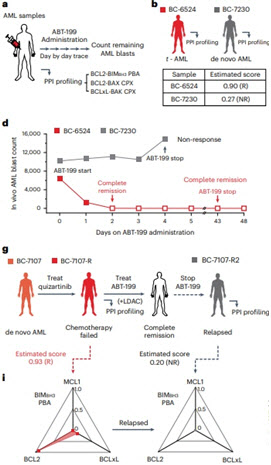
그러나 모든 환자가 동일한 치료 효과를 얻지 못하고, 일시적 관해 후 저항성이 생기는 경우가 있어 ABT-199의 효과를 미리 예측할 수 있는 방법이 필요했다. 연구팀은 단분자 풀다운 및 공면역침강 기법과 단분자 형광 이미징 기술을 통해 약 30,000개의 세포를 분석해 22종의 서로 다른 단백질-단백질 상호작용(PPI) 신호를 정량적으로 검출하는 기술을 개발했다. 이를 통해 다양한 단백질이 서로 어떻게 상호작용 하는지를 정확히 측정할 수 있게 됐다.
|
연구팀은 ABT-199가 BCL2 단백질에 선택적으로 결합하여 BCL2-BAX 복합체를 분해시키고, 이 과정에서 활성화된 BAX 단백질이 암세포의 사멸을 유도하는 것을 확인했다. 이를 통해 ABT-199가 암세포를 죽이는 주요 매커니즘을 명확히 밝혀냈다.
이어 연구팀은 32명의 AML 환자 검체에서 다차원 PPI 프로파일 데이터를 획득하고, 생체 외 수준에서의 약물 반응성과의 상관관계를 분석했다. 그 결과, ABT-199의 민감성(얼마나 잘 듣는지)과 저항성(얼마나 저항하는지)에 영향을 미치는 주요 단백질 복합체를 밝혀냈다. 특히, BCL2-BAX 복합체는 ABT-199의 민감성과, BCLxL-BAK 복합체는 저항성과 관련이 있음을 확인했다.
이 데이터를 바탕으로 연구팀은 개별 AML 환자의 ABT-199 약물 반응성을 예측할 수 있는 ‘고성능 동반진단 바이오마커’를 개발했다. 이 바이오마커는 환자의 세포에서 특정 PPI 신호가 어떻게 변화하는지를 보고, ABT-199가 효과가 있을지를 높은 정확도로 예측할 수 있다.
서울대 윤태영 교수(생명과학부)는 “단분자 공면역침강(SMPC) 기법은 다양한 시료에서 단백질-단백질 상호작용(PPI)을 정밀하게 측정할 수 있는 도구”라며 “이 기술을 통해 복잡한 단백질 상호작용 네트워크를 이해함으로써 분자 진단의 새로운 길을 열어줄 것으로 기대된다”고 말했다.
서울대병원 고영일 교수(혈액종양내과) “이번 연구는 기존에 반응 예측 바이오마커가 부족했던 급성 골수성 백혈병에서 ABT-199(Venetoclax) 요법의 중요성을 부각시키는 의미 있는 성과”라며 “PPI 프로파일링 기반의 이 연구가 향후 급성 골수성 백혈병의 정밀의료 발전에 크게 기여할 것”이라고 연구 의의를 밝혔다.









![[포토] 소방 "포스코 포항제철소서 큰 불 신고"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000360t.jpg)
![[포토] 이대한 '2024시즌 대미를 장식하며 동료들과 함께'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000314t.jpg)
![[포토]의협 대의원총회 참석하는 임현택 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000295t.jpg)
![[포토]잠시 쉬어가는 서울야외도서관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000281t.jpg)
![[포토]‘코리아세일페스타’ 개막…숙박·놀이공원·학습지 등 신규 참여](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000259t.jpg)
![[포토]정부, ‘비위 혐의 다수 발견’ 이기흥 체육회장 등 경찰 수사 의뢰](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000227t.jpg)
![[포토]수능대박을 위해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000202t.jpg)
![[포토]가을의 추억](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000165t.jpg)
![[포토]이보미,오랜만에 쉽지않네](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110900387t.jpg)
![[포토] 이대한 '오늘 홀인원 한 볼입니다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110900174t.jpg)
![[포토] 이대한 '2024시즌 대미를 장식하며 동료들과 함께'](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111000314h.jpg)

![트럼프 전용기 옆자리 그녀…유리천장 깨고 오른팔 등극[파워人스토리]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111000432b.jpg)

