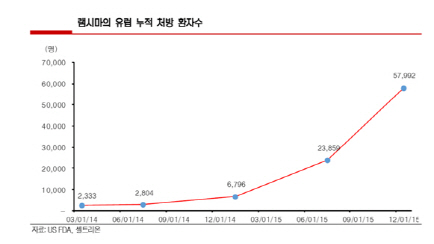
셀트리온에 따르면 지난해 램시마의 유럽 누적 처방환자 수가 5만7992명으로 전년대비 700% 이상 늘었다. 램시마는 유럽 시장에 진출한 초기인 2014년 처방 환자수는 6796명에 그쳤지만 유럽 주요 국가 발매가 이뤄진 지난해 환자 수가 급증했다.
셀트리온은 지난 2013년 8월 유럽 31개국에서 램시마 판매를 동시에 허가 받아 유럽 발매에 돌입했지만 국가별 오리지널 의약품의 특허만료일자가 달라 허가 당시 15개 국가에서만 판매를 시작했다.
지난해 2월 독일, 프랑스, 이탈리아, 스페인, 영국 등 유럽 주요 국가의 오리지널 의약품 특허가 만료돼 이들 국가에서의 판매가 활발히 이뤄지면서 램시마의 처방 환자수가 크게 늘었다.
램시마와 같은 TNF-알파억제제의 세계 시장규모는 약 35조원 규모며 이중 유럽 주요 5개국의 시장 규모는 5조5000억원 가량이다.
셀트리온 관계자는 “램시마가 안전성과 품질, 오리지널의약품과의 동등성을 바탕으로 유럽 현지 의사와 환자에게 오리지널 의약품의 대체 의약품으로 큰 거부감 없이 처방되고 있다”며 “유럽 시장 본격 진출 첫 해에 기대 이상의 안정적 성장을 기록한 만큼, 세계 시장의 50%를 차지하는 미국에서도 허가 이후 시장에 순조롭게 진입할 수 있을 것으로 예상한다”고 말했다.
셀트리온의 램시마는 지난 9일 미국 식품의약품국(FDA) 자문위원회를 통해 판매허가를 권고받았으며, 오는 4월 FDA의 판매 허가 승인을 앞두고 있다.
|
▶ 관련기사 ◀
☞셀트리온, 돌라스타틴 10 유도체 제조방법 특허 취득
☞[마감]코스닥, 이틀째 상승…바이오株 강세
☞1500억달러 가상현실 시장! MWC에 주목하라!









![[포토] 이재경 '핀하이로 쏜다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400197t.jpg)
![[포토] 축시 낭독](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400720t.jpg)
![[포토] 2024 세계한인회장대회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400598t.jpg)
![[포토]유현조,나이스 마무리 퍼트](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400048t.jpg)
![[포토]박도은,핀 공략을 생각한다](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300270t.jpg)
![[포토]"예쁜 피부는 역시" 엘렌실라, W페스타 부스 운영](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300485t.jpg)
![[포토]전국 의대 교수, '의평원 무력화 막을 것'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300350t.jpg)
![[포토]부천국제만화축제 참가한 부천대학교 학생들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300332t.jpg)
![[포토]파란하늘과 가을 꽃](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300310t.jpg)
![[포토]개천절 경축식 만세삼창](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300275t.jpg)
![[포토]이제영,버디 성공을 위하여](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100500561t.jpg)
![24시간 쫓고 또 쫓는다…'무도실무관' 김우빈의 쏜살같은 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100500206t.jpg)
![“텐트 치고 밤샘”…불꽃축제 생각에 설렘 가득한 여의도[르포]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100500298b.jpg)

