식품의약품안전청은 27일 `새 GMP제도 중간평가 및 성과분석` 발표를 통해 제도 시행 후 월평균 허가신청 건수가 80% 줄어들었다고 밝혔다.
새 GMP(Good Manufacturing Practice, 의약품 제조 및 품질관리기준)제도란 의약품 허가 전에 개별 품목에 대한 품질관리를 평가하는 것을 말한다. 종전에는 허가 후 주사제·고형제 등 전반적인 품질관리 수준을 검증하는 수준이었다.
이 제도는 허가 전 3개 제조단위를 미리 생산, 항상 동일한 품질의 의약품이 생산된다는 것을 증명, 문서화하는 `밸리데이션`이 핵심이다. 식약청은 의약품 제조·품질관리시스템 선진화를 위해 지난 2008년부터 새 GMP제도를 시행중이다.
식약청에 따르면 새 GMP제도 시행 이전 전문의약품의 허가신청 건수가 월평균 약 150건에서 제도 시행 이후 약 30건으로 대폭 감소했다.
또한 기존 허가제품 중 미생산 제품 등에 대한 품목 자진 반납 건수도 연평균 최소 1000~9000여건에 달하는 등 의약품 관리 추세가 특화된 제품을 선택, 집중하는 전략으로 바뀌고 있다는 평가다.
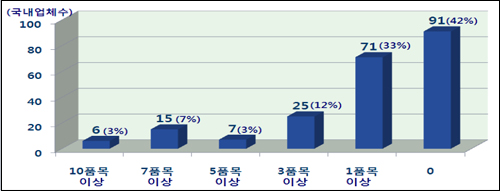
특히 새 제도 도입 후 국내 제조업체 215곳 중 단 한건의 의약품도 허가신청하지 않은 업체가 절반에 가까운 91곳이나 달했다.
|
일정 수준의 품질관리 기준을 갖추지 않은 제약사는 사실상 시장에서 탈락됨으로써 우수품질관리 기준을 갖춘 경쟁력 있는 제약사만 생존하는 효과가 나타난다는 설명이다.
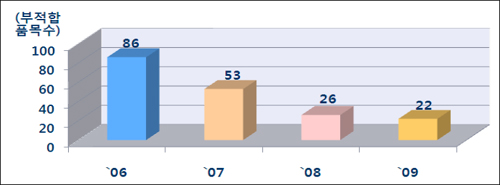
이와 함께 새 GMP제도 시행 이후 의약품 품질 부적합 건수가 2006년 86건에서 지난해 22건으로 감소하는 등 의약품 품질 향상에 기여했다고 식약청은 평가했다.
|
식약청 관계자는 "새 GMP제도 시행 후 품목 구조조정을 통한 제약산업 재편 가능성을 보였으며 우수한 품질의 의약품 공급기반 마련으로 대외경쟁력이 향상됐다"고 설명했다.
▶ 관련기사 ◀
☞`판매중단 보류` 한숨돌린 비만약제약사..그러나
☞비만약 제약사 "식약청, 판매중단 신중히 판단해달라"
☞비만약 제약사 긴급소집..유럽發 안전성 이슈 불똥튀나









![[포토]서울시, 서리풀 공공주택지구 추진](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110501121t.jpg)
![[포토]화재진압 훈련하는 종로구 소방서](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110501083t.jpg)
![[포토]대한축구협회 특정감사 결과 최종 브리핑](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110501019t.jpg)
![[포토]평생당원 초청 간담회 참석하는 한동훈 당대표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110500858t.jpg)
![[포토] 세계최초 8K 온디바이스 AI TV](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110500697t.jpg)
![[포토]추경호, '이재명 1심 선고 생중계해야...투명한 공개가 공공의 이익에 부합'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110500657t.jpg)
![[포토]패딩이 필요해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110500647t.jpg)
![[포토]원내대책회의, '모두발언하는 박찬대 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110500637t.jpg)
![[포토] 훈련장 이동하는 '시니어 아미'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110401152t.jpg)
![[포토] 오세훈 시장과 김병주 MBK 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110400960t.jpg)

![[포토] 롯데 챔피언십 공식 포토콜 단체사진](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110500107t.jpg)


