10일 에이투젠에 따르면 전날 식품의약품안전처가 에이투젠의 주요 파이프라인인 LABTHERA-001의 임상 2a상의 임상시험계획(IND)을 승인했다. 이에 따라 회사는 오는 2026년 8월 종료를 목표로 LABTHERA-001의 안전성과 유효성을 확인할 예정이다.
|
이번 임상은 18세 이상~65세 미만의 여성 104명을 대상으로 하며, 이중눈가림, 무작위배정 등의 방식으로 14일 간 약물을 질내 직접 투약한 뒤 6개월의 모니터링 기간을 거쳐 종료된다.
건강보험심사평가원(HIRA) 빅데이터 개방 포털에 따르면 2022년 기준 국내 질염 환자 수는 170만명에 달한다. 이중 세균성 질염이 차지하는 비중이 40~50%로 가장 크다.
에이투젠 관계자는 “LABTHERA-001은 단순히 치료제라기보다 ‘재발방지제’에 가까워 치료제 자체의 시장규모와는 차이가 있을 수 있다”면서도 “지금은 세균성 질염을 타깃으로 임상 2a상을 진행 중이지만 향후 자궁내막증, 다낭성난소증후군 등으로의 확장 가능성이 있다”고 말했다.
앞서 페링 파마슈티컬스의 ‘리바이오타’와 세레스 테라퓨틱스의 ‘보우스트’가 1·2호 마이크로바이옴 신약으로서 재발성 클로스트리디움 디피실 감염증(CDI) 치료제로 미국 식품의약품(FDA)의 허가를 받아 시장에 나왔다. 하지만 마이크로바이옴 신약에 대한 시장의 높은 기대감에 비해 매출 성장세가 더딘 상테다.
세레스는 올해 1분기 보우스트의 순매출이 1010만 달러(약 144억2000만원)라고 밝혔는데 매분기 지속적으로 환자와 처방건수가 늘고 있다는 점은 특기할만한 부분이지만 재발 예방 등 적응증이 한정적인 까닭에 완만한 성장곡선을 그리고 있다. 다만 업계에서는 세레스가 지난 9월 네슬레 헬스사이언스에 보우스트를 매각하는 절차를 종료함에 따라 내년부터는 성장세에 힘이 실릴 것으로 기대하고 있다.
에이투젠은 앞서 FDA의 허가를 받은 마이크로바이옴 치료제에 비해 LABTHERA-001가 강점을 갖고 있다고 보고 있다. 리바이오타의 경우 건강한 사람의 대변을 제조해 그 미생물총을 내시경으로 환자의 장내에 뿌리는 방식의 CDI 재발방지제다. 접근성이 높지 않을뿐더러 부작용에 대한 우려도 있었다. 보우스트는 최초의 경구용 마이크로바이옴 신약으로 편의성이 높았지만 소화과정에서 담즙이나 위산 등에 의해 유산균이 소실될 수 있다.
글로벌 시장조사기업 맥시마이즈 마켓리서치는 2023년 기준 31억 3605만 달러(약 4조5000억원)였던 세균성 질염 치료제 시장이 2030년 59억 6502만 달러(약 8조5000억원)로 성장할 것으로 예상하고 있다.
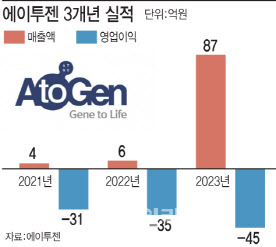
에이투젠은 유한양행이 지분 62.6%를 보유하고 있는 마이크로바이옴 치료제 개발사다. 현재 회사의 주요 매출은 유한양행과 함께 판매하고 있는 혈당과 당화혈색소 수치를 낮추는 효과의 기능성 유산균 ‘혈당엔 유산균 HAC01’이다. 지난해 에이투젠의 매출액은 87억원을 기록했다.
|














![[포토]박성재 법무장관·조지호 경찰청장 탄핵안 가결...즉시 직무 정지](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121201103t.jpg)
![[포토] 작품이 된 생활용품](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200968t.jpg)
![[포토]조국, 징역 2년 확정..의원직 상실](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200952t.jpg)
![[포토] 롯데뮤지엄, '뷔르템베르크 왕실의 주얼리 세트' 전시](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200856t.jpg)
![[포토]법정 나서는 조국혁신당 의원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200841t.jpg)
![[포토]야6당, '12.3 내란 사태' 국정조사 요구서 제출](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200820t.jpg)
![[포토]이재명 대표 만난 정순택 대주교](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200816t.jpg)
![[포토]국민의힘 새 원내대표에 ‘친윤’ 중진 권성동 의원 선출](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200800t.jpg)
![[포토]與 ‘탄핵 가결’ 급물살… 한동훈도 ‘찬성’ 돌아섰다](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200673t.jpg)
![[포토]발표하는 김동헌 고려대 경제학과 교수](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121200511t.jpg)

![[포토]박현경,자기 관리 중요해요](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121100160h.jpg)


