|
메드팩토는 진행성 비소세포폐암(NSCLC) 대상 ‘백토서팁’ 병용요법의 임상 데이터를 미국 면역항암학회(SITC 2024, Society for Immunotherapy of Cancer 2024)에서 공개했다고 11일 밝혔다.
SITC는 면역항암분야에서 가장 큰 규모의 글로벌 학회로 전 세계 63개국, 약 4,600명 이상의 임상의, 과학자, 연구자들을 회원으로 보유하고 있다. 이번 SITC는 11월 6일부터 10일까지 개최됐으며, 메드팩토는 8일(이상 미국 기준)에 ‘백토서팁’과 아스트라제네카 면역항암제 ‘임핀지’(성분명 더발루맙)의 병용 임상 1b/2a상 결과를 발표했다.
메드팩토에 따르면, 이날 데이터 공개와 함께 다수의 해외 제약사 및 연구기관 등에서 ‘백토서팁’의 연구 과정에 큰 관심을 보였다. 특히 일부와는 공동 연구 등에 대해 추가 협의를 진행하기로 했다.
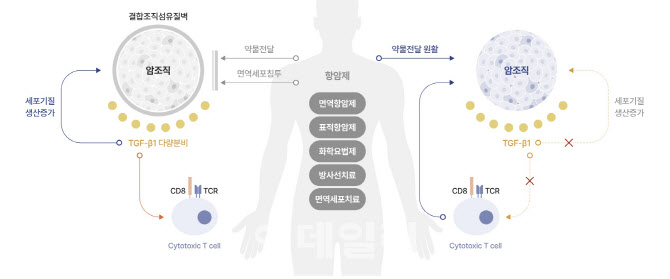
‘백토서팁’은 종양 미세환경 조절과 관련된 TGF-β1 신호전달계를 표적으로 하는 혁신 신약으로, 기존 항암치료제들과 병용투여 시 면역을 활성화하고 전이 및 항암제 내성을 억제해 치료 효과를 극대화하는 새로운 항암치료제다.
이번에 공개된 임상 1b/2a상 결과는 PD-L1 발현율에 따른 치료 효과를 분석한 것으로, 병용요법에 의한 시너지 효과를 확인했다는 점에서 의미가 있다. 특히 PD-L1 발현율이 25% 이상인 환자군에서 객관적 반응률(ORR)은 45.83%, 전체 생존기간 중앙값(mOS)은 41.92개월을 기록했다.
한편 이번 학회에서는 메드팩토 외 미국 국립암연구소(National Cancer Institute), 호주 피터 맥컬럼(Peter MacCallum) 암센터, 멜버른 대학 등 다양한 기관에서 TGF-β 관련 발표를 진행, TGF-β의 항암치료 가능성에 대한 세계적인 높은 관심을 확인하기도 했다.
나이벡, ‘NP-201’ 1b·2a상 승인
나이벡은 호주 ‘인체연구윤리위원회(HREC)’로부터 염증성장질환 치료제 NP-201에 대한 임상 1b/2a상 시험계획(IND)을 승인받았다고 12일 밝혔다.
이번 글로벌 임상 1b/2a상은 피하주사 제형으로 총 78명에게 투약된다. 1b상에서는 24명의 건강한성인을 대상으로 증량 반복투여를 실시해 안전성과 약동학 평가 등을 실시한다. 2a상에서는 경증 및 중증 궤양성 대장염 환자 54명에게 피하주사로 증량 반복 투여를 통해 안전성과 내약성, 약동학 분석 등을 평가한다.
앞서 나이벡은 동일한 약물에 대해 폐섬유증 치료제로 글로벌 임상 1상을 성공적으로 마치며 인체 안전성을 입증한 바 있다.
셀리드, 오미크론 대응 코로나19 백신 3상 투여 완료
셀리드는 오미크론 대응 백신 ‘AdCLD-CoV19-1 OMI’의 임상 3상 시험 대상자에 대한 모집과 투여를 모두 완료했다고 13일 밝혔다.
이번 임상 3상 시험은 국내를 비롯해 필리핀과 베트남에서 코로나19 예방 백신의 마지막 접종 완료 또는 코로나19에 의한 격리 해제 후 최소 16주 이상 경과한 만 19세 이상 성인 자원자 4000명을 대상으로 진행했다.
셀리드는 계획된 모든 대상자 투여 완료 후 4주차 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시해 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 방침이다.
또 AdCLD-CoV19-1 OMI의 조건부 품목허가 심사 일정에 맞춰 WHO 및 세계 각국에서 권고하는 신규 변이주 대응 코로나19 백신을 개발해 정부 유관기관과 협의를 통해 긴급사용승인을 획득한 뒤 국가에 공급할 계획이다.
강창율 셀리드 대표는 “임상 1/2상 시험에서 코로나19 백신의 장기적인 면역 유도 효과와 안전성을 확인했기 때문에 임상 3상 시험에서도 긍정적인 결과를 기대한다”고 말했다.






![[포토]우리 이웃을 위한 크리스마스 선물](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500173t.jpg)
![[포토]메리크리스마스](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400797t.jpg)
![[포토]즐거운 눈썰매](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400779t.jpg)
![[포토]취약계층 금융 부담 완화, '인사말하는 이재연 원장'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400633t.jpg)
![[포토]국민의힘 의원총회, '모두발언하는 권성동 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400506t.jpg)
![[포토]윤석열 대통령 탄핵심판 첫 변론 준비기일 27일 예정대로 진행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400433t.jpg)
![[포토]'더불어민주당 원내대책회의'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400387t.jpg)
![[포토]국무회의 입장하는 한덕수 권한대행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400378t.jpg)
![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)




