1일 이데일리 취재 결과 올리패스(244460)는 자체 개발해 출시한 탈모화장품(HR.101 안티 헤어로스 앰플)과 관련해 허위 광고를 한 것으로 확인됐다. 특히 지난해 해당 제품 광고가 화장품법 위반으로 적발돼 광고정지 처분을 받았음에도, 지속적으로 해당 광고를 해왔던 것으로 드러났다.
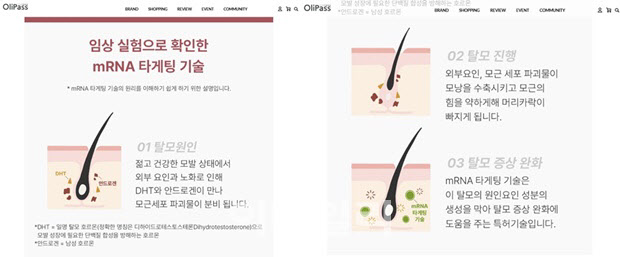
올리패스는 지난해 1월 크라우드 펀딩 플랫폼 와디즈를 통해 탈모화장품 ‘HR.101 안티 헤어로스 앰플’ 첫 론칭을 진행한 바 있다. 당시 보도자료를 통해 “mRNA 타게팅을 헤어에 적용한 탈모증상완화 기능성 앰플”이라며 “해당 기술은 탈모를 유발하는 성분의 생성을 막아 두피 균형을 바로잡아주며, 4주간 인체 적용 시험 결과를 통해 71% 이상의 탈락모 감소 결과를 검증한 바 있다”고 소개했다.
회사 측이 해당 제품 출시 당시 mRNA 기술을 통한 탈모 완화 효과를 집중적으로 마케팅하면서, 와디즈 펀딩 당시 5일동안 목표 달성률 2000%를 기록한 것으로 알려졌다. HR.101 안티 헤어로스 앰플은 올리패스 자회사인 올리패스알엔에이가 유통 판매하고 있고, 자사몰을 통해 판매 중이다.
|
하지만 식품의약품안전처는 올리패스가 HR.101 안티 헤어로스 앰플과 관련해 mRNA 기술을 활용한 탈모 완화 효과를 광고하는 것은 화장품법 위반으로 허위사실에 해당한다고 판단했다. 이는 올리패스가 mRNA 성분 및 기술로 탈모화장품 허가를 받은 것이 아니기 때문이다. 따라서 해당 제품 광고에 mRNA와 그에 따른 효능을 게재하는 것은 없는 사실로 소비자를 기만한 것이라는 지적이다.
식약처에 따르면 올리패스는 2021년 탈모화장품 승인 과정에서 mRNA와 관련된 심사를 받지 않았다. mRNA가 주성분이거나 효능에 핵심적인 역할을 하는 경우 신물질인 만큼 식약처로부터 심사받아야 한다. 하지만 mRNA와 관련이 없었기 때문에 신물질 기능성화장품이 아닌 일반 기능성화장품으로 보고 절차를 거쳐 승인받았다. 실제로 바이오니아의 경우 RNA 탈모화장품 국내 출시를 위해 식약처로부터 보고가 아닌 심사를 받은 바 있다.
|
식약처 관계자는 “해당 광고(올리패스 HR.101 안티 헤어로스 앰플)는 허위 광고다. 광고에서 언급한 ‘임상실험으로 확인한 mRNA 타게팅 기술(탈모를 유발하는 원인인 DHT와 안드로겐 성분 생성 억제)을 활용한 탈모증상 완화’는 기능성화장품으로 보고된 효능효과와 상이하므로 화장품법 위반으로 판단된다”고 말했다.
이와 관련 식약처는 화장품법 위반 사항을 확인한 만큼 올리패스 탈모화장품 광고에 대해 행정처분을 위한 사실 확인에 착수한다는 입장이다. 식약처 관계자는 “올리패스 탈모화장품 광고가 화장품법 위반으로 판단됨에 따라 해당 광고에 대한 점검에 나설 것”이라며 “행정처분을 어느 수위로 할 것인지는 좀 더 들여다봐야 한다. 과거 행정처분에도 또 다시 허위광고를 한 것이라면 가중처벌 대상”이라고 말했다. 또한 식약처는 mRNA 허위 사실 기재 외에도 해당 광고에서 강조된 ‘두피 안티에이징(두피 보습, 두피 탄력, 두피 진정)에 대한 인체적용시험 완료’ 부분에 대해서도 올리패스 측의 실증 자료 검토 후 광고위반 여부에 대해 판단하겠다는 방침이다.
이와 관련 정신 올리패스 회장은 “과거에 광고 정지 처분을 받은 적이 있어서, 문제가 된 광고는 다 걸러진 것으로 알고 있었다. 광고를 담당하던 임원도 다 나가서 화장품 쪽에 집중을 못하고 있는 상황”이라며 “상황을 확인해보고, 문제가 된다면 해당 제품 광고는 내리겠다”고 말했다.
한편 올리패스는 ‘OliPass PNA’라는 RNA 플랫폼 기술로 관절염 치료제(OLP-1002), 노인성 황반변성 및 당뇨성 황반부종 치료제(OLP-1003) 등을 개발하고 있다. 지난해 실적은 매출 약 23억원, 영업적자 약 241억원으로 집계됐다. 매출 23억원 중 탈모화장품 등 기능성화장품 매출이 약 19억원에 이르는 것으로 나타났다.









![[포토] 이즈나 데뷔](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500181t.jpg)
![[포토]첫 싱글 '라스트 벨'로 돌아온 TWS](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500118t.jpg)
![[포토] 의원들과 인사나누는 이재명 대표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500985t.jpg)
![[포토] 2024 개발협력의 날 기념촬영](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500978t.jpg)
![[포토]안전운임제 확대 촉구](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500923t.jpg)
![[포토]허정무 ‘축구협회는 다시 태어나야’](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500080t.jpg)
![[포토]가을의 절정](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500677t.jpg)
![[포토]스테파니 린, 리서치 헤드, 기업거버넌스포럼](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500657t.jpg)
![[포토] 김재홍 국립중앙박물관장, 상형청자 특별전](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500648t.jpg)
![[포토]가슴 뛰는 통일 대한민국을 위하여](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500462t.jpg)




