|
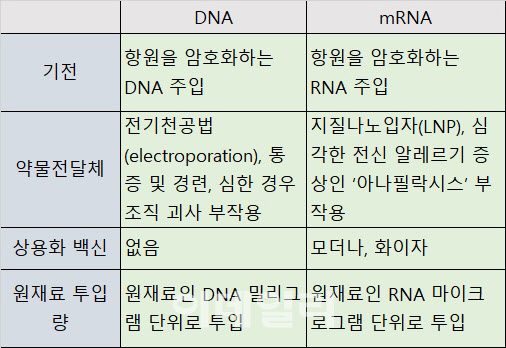
기전상 다른 점은 유전자 전도물질이다. 이재갑 한림대 감염내과 교수는 “DNA와 mRNA 백신은 단백질을 만드는 과정이 다르지만, 결국 세포 안에 들어가서 최종 목표(end point)는 스파이크 단백질이다. 바이러스 유전자를 DNA로 전달할 건지, mRNA로 전달할 건지 정도의 차이라고 보면 된다”고 설명했다.
상용화된 mRNA 백신은 모두 ‘지질나노입자(LNP)’를 약물전달체로 사용한다. LNP를 더 안정된 상태로 만들기 위해 들어가는 PEG(폴리에틸렌글리콜) 때문에 심각한 전신 알레르기 증상인 ‘아나필락시스’ 부작용이 있다. DNA 백신은 임상 단계에서 효능이 입증된 약물전달체는 전기천공법(electroporation)뿐이다. 전기천공 과정 중 통증 및 경련이 일어날 수 있고 심한 경우 조직 괴사 부작용이 있다.
20년 백신 연구개발 경력의 연구원은 “mRNA는 PCR(유전자증폭) 검사처럼 기계가 만든다. 밥통 같은 데서 만들기 때문에 30평 남짓한 곳에서도 몇백만 도스가 나오는 거다. 생산수율과 안전성, QC(품질관리, Quality control)가 뛰어나다”고 말했다. 이어 “DNA가 박테리아에서 생산할 때 박테리아 컨트롤, 무균 등 여러 복잡한 과정이 더 들어가게 된다. 박테리아로 생산하다 보면 안전성 테스트도 많이 해야 한다. 생산 과정이 더 들어가는 만큼 기계로 찍어낸 mRNA보다 생산 단가가 높아진다”고 덧붙였다.
DNA가 mRNA보다 생산단가가 높아지는 요인은 또 있다. DNA 백신에는 원재료인 DNA가 밀리그램 단위로 들어가며, mRNA는 마이크로그램 단위로 들어간다. 1밀리그램은 1000마이크로그램이다. 백신 원재료인 DNA와 mRNA가 많이 들어가면 갈수록 단가는 당연히 높아질 수밖에 없다.
바이오기업 임원은 “mRNA 백신 상용화 빅파마들도 생산단가에 대한 고민을 하고 있으며, mRNA 양을 줄이고자 노력하고 있다. 모더나는 100마이크로그램, 화이자는 30마이크로그램이 들어가고, 품목허가를 앞두고 있는 큐어백은 12마이크로그램이다. DNA 백신은 밀리그램 단위로 들어가며, 생산단가는 mRNA보다 몇 배나 뛸 수밖에 없다”고 분석했다.
DNA 코로나 백신사 미국 이노비오는 지난해 초 백악관까지 초대됐으며, 미국 정부의 전폭적인 지원을 받았다. 하지만 작년 7월 발표한 초기 임상 시험 결과에서 “임상시험 대상 94%에서 항체반응이 있었다”고만 밝히고, 중화항체 생성 임상시험자수를 공개하지 않았다. 중화항체는 코로나바이러스와 싸우는 우리 몸속 무기다. 임상시험에서 혈중 중화항체량과 항체생성 여부가 백신으로서 중요한 지표다.
결국 지난해 9월 미국 식품의약국(FDA)은 이노비오에 임상 보류 조치를 내렸다. 미국 정부는 기존에 지원하기로 했던 임상 2상까지만 투자하고, 3상부터는 지원을 중단하기로 했다. 반면 이노비오와 비슷한 시기에 백신 개발에 착수한 모더나와 화이자는 임상 시험 초기부터 중화항체 형성에 대해 투명하게 공개했다. 모더나 mRNA 백신은 초기 임상참여자 45명 모두에게서 중화항체 생성, 화이자는 임상참여자 24명 전원에서 중화항체가 형성됐다고 발표했다.









![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![강 건너고 짐도 나르고…‘다재다능’ 이상이의 무한변신 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24113000161h.jpg)



