23일 GC녹십자에 따르면 코로나19 팬데믹 등으로 미뤄졌던 알리글로(IVIG-SN 10%)의 FDA 현장실사가 오는 4월 중 진행될 예정이다. 하반기 회사측이 FDA에 생물학적제제허가(BLA)를 재신청하면 약 6개월간의 리뷰를 거쳐 허가가 이뤄질 것으로 예상된다. 업계에서는 내년 초 허가가 가능할 것으로 예상하고 있다.
알리글로는 사람의 혈액 내 액체성분인 혈장에서 특정 단백질을 분리·정제해 만든 고농도 면역글로불린 제제다. 선천성 면역결핍증이나 혈액암·조혈모세포이식 등으로 인한 후천성 면역결핍증, 자가면역질환과 같은 면역결핍질환을 치료하는 데 사용된다.
GC녹십자는 2015년 면역글로불린 함유량이 낮은 ‘IVIG-SN 5%’의 BLA를 신청하면서 처음 미국 혈액분획 제제 시장에 도전했지만 이후 FDA로부터 두 차례 보완요구서한(CRL)을 수령하며 허가신청을 포기한 바 있다. 당시 CRL 수령 사유는 제조공정 관련 자료 보완에 관한 내용이었던 것으로 알려졌다. 이후 농도를 높인 IVIG-SN 10%로 6년만에 FDA의 문을 다시 두드렸다. GC녹십자는 IVIG-SN 10%가 품목허가를 받으면 IVIG-SN 5%의 BLA도 재제출해 재도전에 나설 방침이다.
|
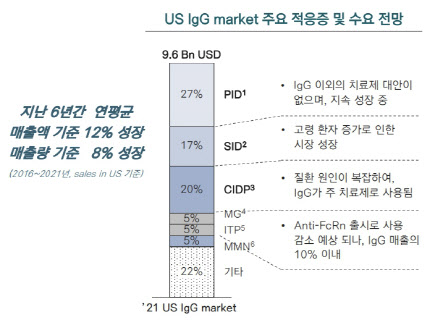
GC녹십자가 이 시장을 포기하지 않고 끈질기게 도전하는 이유는 시장성이 좋기 때문이다. 미국의 면역글로불린 시장 규모는 지난해 기준 96억 달러(한화 약 12조3000억원)로, 품목허가를 받으면 1%의 시장점유율만 차지해도 1200억원 이상의 매출을 올릴 수 있다. 특히 최근에는 자가면역질환이 늘어나 면역글로불린 시장이 연 평균 5%씩 성장하고 있는 상황이다. 증권업계에서는 GC녹십자가 미국 시장에서 최대 6%까지 차지할 수 있을 것으로 내다보고 있다.
회사에 따르면 알리글로는 지난 2020년 완료한 북미 임상 3상에서 FDA 가이드라인에 준한 유효성 및 안전성 평가 변수를 모두 만족시켰다. 이후 2021년 2월 FDA에 BLA를 제출했고 같은 해 10월 코로나19로 GC녹십자 충북 오창공장 실사 대신 FDA가 비대면 실사에 나섰다. 하지만 FDA는 비대면 실사에 한계가 있어 오창공장 현장실사가 필요하다며 지난해 2월25일 다시 CRL을 통보했다. 이로써 품목허가 시기도 당초 예상에서 약 1년가량 늦춰졌다.
GC녹십자는 최근 미국에서 혈액제제 사업을 담당해왔던 미국법인 GC목암의 사명을 GC바이오파마 USA로 변경, 이곳을 거점으로 알리글로 현지 공급 및 판매를 진행하게 된다. 회사는 미국에서 시장의 50%를 차지하는 전문약국 채널을 집중 타깃할 계획이다. GC녹십자 관계자는 “전문약국 채널의 경우 평균 공급가격이 높고 코로나19 이후로 지속적으로 성장해왔다”며 “전국단위 영업조직이 필수적이지 않아 소수 영업인력으로 매출을 극대화할 수 있어 효율적인 전략이 될 것”이라고 설명했다.
혈액제제가 FDA 승인을 받더라도 실제 매출이 발생하는 시기는 2024년 하반기가 될 전망이다. 서근희 삼성증권 연구원은 “국내 기업이 미국에서 직접 판매하는 경우 초기 증가하는 비용 부담 대비 더딘 성장성을 경험한 바 있어 알리글로 역시 FDA 승인보다는 미국 출시 이후 성장성이 관건”이라고 말했다.








![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![[포토]이틀 연속 폭설에 눈 쌓인 북한산](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801096t.jpg)


![“신장 면화 안산다고? 유니클로 불매” 들끓는 中 민심[중국나라]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112901024b.jpg)

